Химические свойства металлов
Химические свойства металлов определяются слабой связью валентных электронов с ядром атома. Атомы сравнительно легко, отдают электроны, превращаясь при этом в положительно заряженные ионы.
 .
.
Поэтому металлы являются хорошими восстановителями. В этом их главное и наиболее общее химическое свойство. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее взаимодействует с другим веществом. О восстановительной способности металла можно судить по его месту в периодической системе элементов Д. И. Менделеева.
С увеличением порядкового номера элемента одной подгруппы увеличивается радиус атома, сила притяжения наружных электронов ядром ослабевает, а это ведет к увеличению металлических свойств – к возрастанию восстановительной активности.
В периоде с увеличением порядкового номера элемента металлические свойства уменьшаются, так как увеличивается заряд ядра, а радиус атома уменьшается. Вследствие этого сила притяжения наружных валентных электронов возрастает.
Также о восстановительных способностях металлов судят по электродным потенциалам, значения которых также являются периодической функцией порядкового номера элемента. Так как потенциалы металлов зависят не только от природы металлов и раствора, но и от степени окисления его ионов, то сравнение потенциалов необходимо проводить либо при одинаковой, либо при максимальной степени окисления. К наиболее сильным восстановителям относятся щелочные и щелочноземельные металлы, бериллий, магний, алюминий, лантаноиды и d-металлы III и IV групп. Наиболее положительные электродные потенциалы имеют d-металлы I группы и платиновые металлы.
Как восстановители, металлы должны вступать в реакции с различными окислителями, среди которых могут быть простые вещества (неметаллы) и сложные: кислоты, соли менее активных металлов и некоторые другие вещества. Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием ∆G < 0 или Еок/в >  , где Еок/в и
, где Еок/в и  – потенциалы окислителя и металла.
– потенциалы окислителя и металла.
Металлы взаимодействуют :
1) с кислородом, образуют оксиды 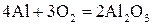 ,
,
2) с галогенами – галогениды 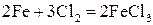 ,
,
3) с серой – сульфиды 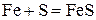 ,
,
4) с азотом – нитриды 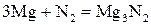 ,
,
5) с фосфором – фосфиды  ,
,
6) с углеродом – карбиды 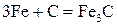 ,
,
обычно карбиды получают при нагревании оксидов металлов с коксом в электропечах, например:
 ,
,
7) с кремнием – силициды  ,
,
8) с бором – бориды  ,
,
9) с водородом – гидриды 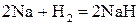 ,
,
10) с водой – гидроксиды (щелочные и щелочноземельные металлы
 …)
…)  ,
,
11) с водными растворами солей менее активных металлов  ,
,
12) с щелочами взаимодействуют металлы, гидроксиды которых амфотерны ( 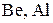 ):
):
в расплаве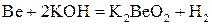 ,
,
в растворе .
.
13) Так как металлы и их катионы имеют вакантные молекулярные орбитали, то большинство из них являются комплексообразователями. Способность к комплексообразованию растет с увеличением заряда иона и уменьшением его радиуса, зависит от природы металла и наличия вакантных орбиталей у его ионов. Комплексные соединения, особенно Fe, Co, Cu, Mn, Cr, V, Zn, Mo, входят в состав биологических систем, включая ферменты, переносчики крови т. д. Например, в состав гемоглобина крови входит комплексное соединение железа.
Дата добавления: 2020-03-21; просмотров: 636;











