ПРОИЗВОДСТВО АЛЮМИНИЯ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА АЛЮМИНИЯ
1.1. Общие положения
Современное производство алюминия основано на электролитическом разложении глинозема (Al2O3) с выделением на катоде металлического алюминия, а на аноде – газообразных продуктов электролиза. На рис.1.1 схематически изображена электролитическая ячейка, в которой можно произвести электролиз криолитоглинозёмных расплавов.
Все содержимое ячейки размещается в керамическом тигле 1. Со стороны дна установлена графитовая пластина 2, к которой подведен отрицательный полюс от источника постоянного тока (катод). В верхней части ячейки помещается угольный анод, к которому подведен положительный полюс источника тока. Анод погружается в расплавленный электролит 3, роль которого заключается, во-первых, в образовании токопроводящей среды между катодом и анодом, во-вторых, в растворении глинозема.
Последний фактор весьма важен, т.к. он позволяет растворить порошковый оксид алюминия в жидкой фазе, где становится возможным его электролитическое разложение. В электролите Al2O3 диссоциирует на положительные ионы алюминия (катионы) и отрицательные кислородсодержащие ионы (анионы). Ниже слоя электролита размещается расплавленный алюминий 4, фактически выполняющий роль катода.
Присоединим ячейку к положительному и отрицательному полюсам источника тока и в цепи появится прямой электрический ток, т.е. поток электрических зарядов. В металлических проводниках и графите ток переносится за счет электронов (проводники I-го рода), а в жидких электропроводящих средах (электролитах) – за счет ионов (проводники II-го рода). Проводники I-го рода, подводящие ток к электролитам, называют электродами.
Электрический ток, проходящий через электролит, вызывает в электролите химические изменения. Этот процесс носит название электролиза. В нашей ячейке на катоде появляются избыточные электроны (е-), которые захватываются катионами алюминия и приводят к его восстановлению по реакции
Al3+ + 3е- = Al
На аноде происходит поглощение электронов от отрицательно заряженных анионов. В суммарном виде анодная реакция может быть записана в следующем виде:
2О2- - 4е- + С = СО2
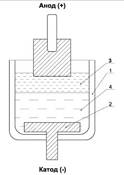 Рис. 1.1. Схема электролитической ячейки
Рис. 1.1. Схема электролитической ячейки
| Образовавшийся на катоде алюминий, будучи по удельному весу тяжелее электролита, накапливается на дне ячейки и в последующем выполняет функции катода. Углекислый газ за счёт взаимодействия с углеродом анода частично восстанавливается по реакции СО2 + С = 2СО и свободно удаляется от анода в систему газоотсоса. Добавим к этому, что в качестве электролита алюминиевой ячейки повсеместно используется криолит, имеющий формулу смеси двух солей 3NaF × AlF3 или в суммарном виде Na3AlF6. |
Криолит в расплавленном состоянии хорошо растворяет глинозем и достаточно электропроводен для использования в электролизе. Электролит по удельному весу легче металла, поэтому он находится над поверхностью алюминия в виде расплавленного слоя.
В таком виде способ производства алюминия электролизом глинозема в расплаве криолита был изобретен одновременно двумя инженерами П.Эру (Франция) и Ч.Холлом (США) в 1886г. и до настоящего времени в принципе сохраняется неизменным.
Агрегат для промышленного производства алюминия носит название алюминиевого электролизера или алюминиевой ванны (рис.1.2). В конструкцию электролизера заложены те же основные принципы, что и в элементарной ячейке на рис.1.1. Содержимое электролизёра – расплавленный электролит и алюминий находятся в ванне, ограниченной угольной подиной и бортовой футеровкой. Ниже подины размещена футеровка из огнеупорного и теплоизоляционного материалов. Ток к подине подводится с помощью стальных стержней (блюмсов), соединенных с катодной ошиновкой. Через анодную ошиновку ток подводится к анодному устройству и непосредственно к угольным анодам. Анод находится в полупогруженном состоянии в электролите, расстояние между анодом и расплавленным алюминием носит название междуполюсного расстояния (МПР).
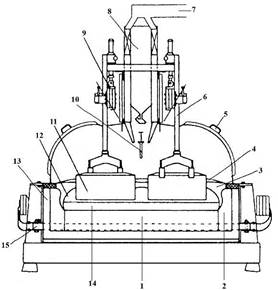
Рис. 1.2. Схема алюминиевого электролизёра:
1-угольная футеровка; 2-бортовые блоки; 3-бортовая настыль;
4-укрывной материал; 5-съёмные крышки; 6-анододержатели;
7-коллектор анодных газов; 8-бункер глинозёма;
9-анодная шина; 10-пробойник АПГ; 11-анод;
12-электролит; 13-бортовая теплоизоляция; 14-расплавленный
алюминий; 15-блюмс
1.2. Электрохимия процесса электролиза
Чтобы вызвать катодный разряд положительно заряженного иона, ему необходимо придать дополнительный отрицательный потенциал. Потенциал, требуемый для выделения на катоде того или иного металла (он носит название катодного потенциала), зависит от природы катиона и его концентрации. Подобные рассуждения можно привести и для анодного процесса и ввести понятие анодного потенциала.
Известные химические элементы можно выстроить в ряд нормальных электродных потенциалов (при 25оС по водородной шкале):
| Li | K | Ca | Na | Mg | Al | Zn | Fe | H2 | Cu |
| -3,02 | -2,93 | -2,88 | -2,72 | -1,87 | -1,3 | -0,76 | -0,441 | 0,0 | +0,33 |
Ряды нормальных электродных потенциалов дают возможность установить, что катионы металлов, стоящие справа от алюминия, имеют меньший потенциал выделения и выделяются на катоде предпочтительнее, чем алюминий. Катионы металлов, стоящих слева от алюминия, имеют повышенные катодные потенциалы и будут оставаться в электролите, не выделяясь на катоде.
Таким образом, в солевом расплаве электродный потенциал алюминия существенно меньше, чем у других составляющих электролита (K, Li, Ca, Na, Mg), что и обеспечивает его электрохимическую устойчивость в процессе электролиза.
Чтобы начался электролиз, к электродам ячейки необходимо приложить напряжение не меньше, чем напряжение разложения, т.е. минимальное напряжение, которое необходимо приложить к электродам, чтобы началось электролитическое разложение вещества (ЕНР):
ЕНР = Еа – Ек,
где Еа и Ек – анодный и катодный потенциалы.
Чтобы шел электролиз, величина ЕНР должна быть повышена на сумму так называемых перенапряжений: анодного Рa и катодного Рк:
U = ЕНР + Рa + Рk
Значение перенапряжения тем больше, чем больше плотность тока, т.е. сила тока в амперах, приходящаяся на единицу рабочей поверхности электрода.
Напряжение разложения глинозема, растворенного в криолитоглиноземном электролите, составляет 2,2 В. При электролизе с инертным анодом (например, платиновым) и алюминиевым катодом идет реакция с выделением кислорода на аноде и алюминия на катоде:
2Al2O3 ® 4Al + 3O2
Если используется угольный анод и суммарная реакция идет с выделением на аноде СО2, то для её осуществления требуется меньше энергии и напряжение разложения составит 1,189 В.
Однако фактическое напряжение разложения глинозема на промышленном электролизере на 0,3-0,5 В выше, чем расчетное. Объясняется это тем, что выделяющийся на аноде СО2 образуется не напрямую, а через промежуточные оксиды углерода с меньшим содержанием кислорода:
СхОу, где х > у.
Разложение промежуточных оксидов идет замедленно, поэтому при электролизе они всегда присутствуют на поверхности анода. Для их разложения и удаления с поверхности анода конечных продуктов электролиза требуется более высокий положительный потенциал анода и фактическое значение напряжения разложения выше, чем расчетное.
Практическое значение напряжения разложения определяют на промышленных электролизерах путем измерения обратной электродвижущей силы (ЭДС), т.е. напряжения на ванне в момент отключения серии от источника тока. При анодной плотности тока
0,8 А/см2 обратная ЭДС составляет 1,45-1,65 В. Значение обратной ЭДС и перенапряжение растут со снижением химической активности анодного материала (углерода) и уменьшаются с повышением температуры в электролизере.
Значение обратимых напряжений разложения других компонентов электролита AlF3, NaF, MgF2, CaF2 намного выше ЕНР глинозема и равны соответственно 3,97; 4,37; 4,61; 5,16 В. Они кратно превышают ЕНР глинозема и при стандартных условиях процесса электролиза электролитическое разложение составляющих электролита не происходит.
1.3. Расчет основных производственных показателей алюминиевого электролизера
Количество алюминия, которое можно получить при электролизе, рассчитывается, исходя из закона Фарадея, по следующей формуле:
М = 0,336 I tht кг,
где I – сила тока на серии, кА; t – время, ч; ht – выход по току, ед.; 0,336 – электрохимический эквивалент алюминия, г/А-ч.
Показатель выхода по току ht имеет следующий физический смысл. Выход по току рассчитывается как отношение количества алюминия, фактически полученного при электролизе, к его количеству, которое должно было выделиться теоретически согласно закону Фарадея. Практически из алюминиевой ванны извлекается несколько меньшее количество металла, чем это следует из формулы M = 0,336 Itht. Часть металла теряется, поэтому значение ht всегда меньше единицы.
Указанные потери металла в ванне можно разделить на прямые и косвенные. К прямым относятся потери алюминия за счёт окисления растворённого в электролите металла анодными газами. Чем выше растворимость алюминия в электролите, тем выше прямые потери. К косвенным потерям можно отнести снижение выхода электролитического алюминия за счет всякого рода утечек тока, т.е. прохождения части тока минуя междуполюсный зазор.
Выход по току характеризует эффективность использования тока на том или ином электролизере и является важным техническим показателем процесса электролиза.
Для расчёта выхода по току, исходя из суточной производительности электролизёра, можно применить следующую формулу (К. Гротхейм и Х.Кванде):
ht=[M(Al)24/(8,052·I)]·100 (%),
где M(Al)24 - наработанное количество алюминия за сутки, кг; I -сила тока на серии, кА.
Расчет также можно произвести, исходя из электрохимического эквивалента и наработки металла за период времени t:
ht = M(Al) / I t 0,336 (%),
Другой показатель эффективности технологии электролиза – удельный расход энергии в постоянном токе на единицу произведенного алюминия. Определяется он делением количества затраченной электроэнергии на полученное количество алюминия. Количество затраченной электроэнергии W определяется по формуле
W = I Uср t , кВт∙ч
где Uср – среднее напряжение на электролизере, В.
Удельный расход электроэнергии можно рассчитать по формуле
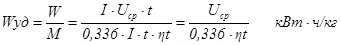

На практике часто применяют величину, обратную удельному расходу электроэнергии – выход по энергии, т.е. выход алюминия в граммах на 1 кВт·ч
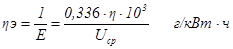
Рассмотрим далее, как рассчитать среднее напряжение Ucp на электролизере. Для этого применим формулу:
Ucp = Up + DUо + DUа.э. В,
где Up – рабочее напряжение в самом электролизере; DUo – падение напряжения в катодной, анодной ошиновке и стояках; DUа.э.– повышение среднего напряжения за счет анодных эффектов.
Рабочее напряжение складывается из следующих составляющих:
Uр = Енр. + DUэл. + DUк + DUа ,
где Енр – напряжение разложения Al2O3 плюс катодное и анодное перенапряжение (или обратная ЭДС); DUэл, DUк, DUа – перепад напряжения соответственно в электролите, катодном и анодном узлах.
Повышение среднего напряжения за счет анодных эффектов рассчитывается по формуле
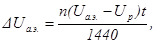
где Uа.э. – среднее напряжение анодного эффекта; n, t – число анодных эффектов в сутки и средняя их длительность в минутах; 1440 – количество минут в сутках.
Падение напряжения в электролите (1,3-2,0 В) обусловлено его омическим сопротивлением. В упрощенном виде его можно рассчитать по формуле
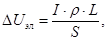
где r - удельное сопротивление электролита, Ом×см; S – сечение токопроводящей части электролита, см2; L – междуполюсное расстояние, см.
Эта зависимость должна быть уточнена с учётом геометрии анода и газонаполнения электролита, т.е. должно быть учтено дополнительное напряжение от наличия пузырьков газа (по К. Гротхейму всего 1,5-2,0 В).
Количество оксида алюминия (глинозема), израсходованного в процессе электролиза за время t (ч), составит:
PAl2O3 = 0,634 I t ht кг,
откуда теоретический расход Al2O3 должен составить
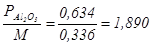 на 1 кг алюминия.
на 1 кг алюминия.
Расход углерода за единицу времени на электрохимические и химические реакции, протекающие в электролизере, зависит не только от выхода по току, но и от состава анодных газов, точнее, от содержания в них СО, обозначаемого через «х».
Удельный расход углерода на 1 кг алюминия составит:
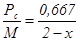 кг на 1 кг алюминия
кг на 1 кг алюминия
Расход углерода при содержании 100% СО2 составит 333,5 кг, а при 100% СО – 667 кг на тонну алюминия. При реальном отношении СО2 : СО = 50 : 50 % расход составит 445 кг на тонну алюминия.
1.4. Электролит
Электролит – это среда, в которой протекают основные электрохимические превращения в алюминиевой ванне. К составу электролита выдвигается целый ряд обязательных условий.
Во-первых, электролит должен растворять необходимое количество глинозема, достаточное для ведения электролиза как минимум до поступления новой порции глинозема; все добавки понижают как растворимость глинозёма, так и скорость его растворения, что нежелательно, т.к. способствует образованию осадков;
Во-вторых, электролит должен быть электропроводен, т.к. в узком зазоре междуполюсного пространства не должно быть большого падения напряжения и соответственно выделения избыточного количества тепловой энергии; в противном случае возможен перегрев электролита и снижение выхода по току.
В-третьих, температура плавления электролита должна быть относительно невысокой, что снизит тепловые потери и энергетические затраты на электролиз.
В-четвертых, состав электролита должен быть стабилен, а потери его за счет разложения и перехода части материала в газовую фазу минимальными.
В-пятых, электролит должен отвечать целому ряду дополнительных требований, а именно: иметь низкую вязкость, достаточное межфазовое натяжение на границе с расплавленным алюминием, не пропитывать и не разрушать футеровку электролизера.
В наибольшей степени этим требованиям отвечает расплавленный криолит 3NaF×AlF3, представляющий собой основной компонент электролита современного электролизера. Путем корректировки его состава по соотношению NaF:AlF3, а также введением ряда модифицирующих добавок технологам удается достичь оптимального состава электролита и получить ожидаемый результат при электролизе. Несмотря на многолетние усилия исследователей найти какой-либо подходящей замены криолиту не удалось.
В химически чистом криолите молярное отношение
NaF:AlF3 равно трем, а само оно носит условное название криолитового отношения (к.о.). Электролит на основе химически чистого криолита при к.о., равным 3, называется нейтральным. Если к.о. более 3, т.е. имеется избыток NaF, то такой электролит называется щелочным. Напротив, электролит с избытком фтористого алюминия и к.о. ниже 3 называют кислым.
Как правильно выбрать криолитовое отношение для получения электролита с оптимальными свойствами? Практика показала, что, вводя в состав электролита избыток AlF3, можно улучшить целый ряд его свойств. Прежде всего, избыток фтористого алюминия снижает растворимость в электролите алюминия, а это предотвращает окисление его анодными газами и способствует повышению выхода по току. Растворимость алюминия в чистом криолите составляет 0,08%, а в электролите с к.о. = 2,1 предельная концентрация снижается до 0,035%, т.е. более чем в 2 раза.
Если температура плавления чистого криолита равна 1010оС, то за счет снижения к.о. до 2,2-2,4, а также одновременного введения других добавок и растворенного глинозема это значение удается снизить до 930-945оС, а электролиз вести при температуре 950-955оС. При этом важна не только абсолютная температура начала кристаллизации (или плавления) электролита, но и величина перегрева, так как растворимость металла быстро снижается по мере уменьшения перегрева электролита. Под перегревом понимается разница между реальной температурой электролита в ванне и температурой его кристаллизации. Если удается вести электролиз с перегревом электролита относительно начала кристаллизации на 8-10оС, то это дает существенное повышение выхода по току.
Плотность кислых электролитов снижается по мере роста содержания в них AlF3, что создает лучшие условия для разделения жидкого алюминия и электролита. Так, если плотность жидкого алюминия составляет около 2,3 г/см3, а чистого криолита - 2,1 г/см3, то разница в удельных весах равна 0,2 г/см3. Со снижением к.о. до 2,2 эта разница возрастает до ~ 0,26 г/см3.
Добавка фтористого алюминия, также как и ряда других фторидов, повышает межфазовое натяжение на границе металл-электролит, обеспечивая тем самым более надежное разделение двух жидких фаз.
Однако избыток фтористого алюминия в электролите имеет и заметное негативное влияние. В кислых электролитах снижается как абсолютная растворимость глинозема, так и скорость этого растворения, что приходится компенсировать организацией более частой подпитки электролизеров и использованием специальных сортов глинозема с активированной структурой. Так, если в чистом криолите растворимость Al2O3 равна 12,4% (по массе), то при к.о. = 2,2 она снижается на 1,5%.
Аналогичным образом изменяется и электропроводность электролита. При таком же снижении криолитового отношения электропроводность уменьшается с 2,87 до 2,25 Ом-1см-1, поэтому для предотвращения перегрева электролита в узкой зоне междуполюсного пространства значение МПР приходится уменьшать, компенсируя общий рост омического сопротивления.
В процессе электролиза под влиянием высоких температур происходит частичное разрушение структуры криолита с образованием летучих веществ. Это подтверждается тем обстоятельством, что основной составляющей парогазовой фазы над поверхностью электролита является соединение NaF×AlF3, в котором содержание AlF3 значительно больше, чем в электролите.
В результате потерь при электролизе преимущественно фтористого алюминия криолитовое отношение электролита постепенно возрастает. Часть улетучившихся фтористых солей удается уловить, регенерировать в системе газоочистки и вернуть в электролизеры, однако потери AlF3 в количестве 12-25 кг из расчета производства 1т алюминия необходимо восполнять свежим фтористым алюминием.
Следует отметить, что из-за большой летучести фтористого алюминия вводить его в электролит нужно таким образом, чтобы избежать прямого попадания в расплав.
Важное свойство электролита – его вязкость в расплавленном состоянии. От вязкости электролита зависят такие процессы, как усреднение концентрации глинозема, скорость отстаивания электролита от капелек металла, удаление пузырьков анодного газа из междуполюсного зазора и т.д. Повышенную вязкость следует считать недостатком электролита того или иного состава. Вязкость резко снижается с ростом температуры перегрева электролита, однако такое снижение вязкости нельзя считать приемлемым, т.к. оно сопровождается неблагоприятными последствиями, характерными для перегретых электролитов. Более приемлем вариант снижения вязкости электролита путём корректировки его состава.
Вязкие электролиты удерживают повышенное количество частиц взвешенного металла («металлический туман») и пузырьков анодного газа, их удельная электропроводность соответственно снижается. Аналогичным образом воздействует углерод, попадающий в электролит в виде пены и плохо отделяющийся из вязких электролитов.
Отметим также, что наибольшая вязкость при температуре электролиза (@ 2-3 сП) имеет место для чистого криолита при к.о. = 3,0. При корректировке состава электролита в сторону избытка или недостатке AlF3 вязкость расплава довольно резко снижается.
В мировой практике многие годы сохраняется устойчивая тенденция к снижению криолитового отношения и ведению технологии электролиза на все более кислых электролитах. Избыточное количество фтористого алюминия в электролите повышается до 8-14% (по массе), что соответствует к.о. = 2,15-2,45. Суммарным результатом «закисления» электролитов можно считать повышение выхода по току и снижение удельного расхода электроэнергии на тонну произведенного алюминия.
В то же время для работы на кислых электролитах необходимо выполнить целый ряд предварительных условий. К ним можно отнести: применение систем автоматического питания глинозёмом, использование «песчаного» глинозема, работу на низких зеркалах металла, применение «сухой» очистки газов, а также решение проблем по упорядочению магнитных и газодинамических процессов в электролизерах, особенно при увеличении их единичной мощности.
Регулирование криолитового отношения не является единственным способом улучшить свойства электролита. Для этих целей в промышленности применяют модифицирующие добавки, наиболее распространенными из которых можно назвать соли CaF2, MgF2 и, значительно реже, LiF.
Фторид кальция CaF2 всегда присутствует в электролите, поскольку естественным источником этой соли служит оксид кальция СаО, содержащийся в виде примеси в глиноземах. Оксид кальция, попадая в электролит и вступая во взаимодействие с фтористым
алюминием по реакции
3CaO + 2AlF3 ® 3CaF2 + Al2O3 ,
переходит во фторид кальция.
За счет естественного поступления концентрация CaF2 в электролите поддерживается на уровне 2-4%, а за счет искусственного введения может быть повышена до 5,0-8,0%. Соль CaF2 уменьшает температуру кристаллизации электролита и соответственно температуру электролиза, увеличивает межфазовое натяжение на границе электролит – жидкий алюминий, но несколько уменьшает растворимость алюминия в электролите.
Первые два фактора благоприятно воздействуют на результаты электролиза. В то же время отмечается и негативное влияние CaF2 на свойства электролита: снижается не только растворимость глинозема в электролите, но и скорость его растворения, возрастает плотность, снижается электропроводность. Поэтому верхний предел по содержанию CaF2 целесообразно установить на уровне 5,0-8,0%. Следует также учесть, что более высокое содержание фтористого кальция грозит образованием осадков и настылей на подине электролизера.
Другая модифицирующая добавка – фторид магния MgF2 попадает в электролит преимущественно из глинозёма в виде оксида магния. Однако количество его в виде сопутствующей примеси в сырье, как правило, невелико. Переход MgO во фторид происходит по аналогии с оксидом кальция.
Действие MgF2 во многом аналогично соли CaF2, но проявляется оно сильнее. Так, например, добавка 1% (по массе) CaF2 снижает температуру плавления электролита на 3ºС, а 1% MgF2 примерно на 5ºС. Поэтому введение этого модификатора возможно только при чистых подинах и устойчивых уровнях электролита. В противном случае неизбежно затвердевание осадков в подовые настыли и нарушение процесса электролиза, падение уровней электролита.
Содержание фтористого магния в промышленных электролитах, как правило, фоновое, т.е. только за счёт естественного поступления с сырьём, и не превышает 0,5-1,5 %. Введение этой соли достаточно рискованно из-за возможности образования подовых настылей, резких изменений уровня электролита. В последние годы эта соль в качестве добавки используется довольно редко. Рекомендованное суммарное содержание CaF2 + MgF2 не должно превышать 8-9%.
Фторид лития LiF является наиболее сильной модифицирующей добавкой к электролиту в части снижения температуры начала кристаллизации и повышения электропроводности. В электролит вводится до 3-4% солей лития (в пересчете на LiF). Каждый процент LiF снижает температуру кристаллизации на ~ 10оС и увеличивает электропроводность на 3%. Добавка литиевого модификатора вносится, как правило, в виде карбоната лития Li2CO3, который взаимодействует с фтористыми соединениями электролита с образованием фторида лития и глинозема.
Характерны результаты работы завода Mead (Kaiser Aluminium) с добавкой лития. Наиболее значимый результат – повышение на 3-4% анодной плотности тока, а также снижение на 50% содержания фтористых соединений в отходящих от электролизёра газах. Отмечено снижение выхода по току, а удельный расход электроэнергии на 1 т Al практически не изменился. Общий экономический эффект оказался положительным, однако это зависит от многих дополнительных факторов и, в частности, от стоимости электроэнергии. Чаще всего введение в электролит солей лития рассматривают как способ повышения производственной мощности серии электролиза с минимальными затратами.
Основным препятствием широкого использования литиевой соли можно считать ее высокую стоимость и относительно низкие объемы производства. Кроме того, небольшие количества металлического лития, образующиеся в процессе электролиза и попадающие в катодный металл, негативно сказываются на некоторых свойствах алюминия, в частности, на последних стадиях проката листа и фольги.
Весьма существенно воздействует на свойства электролита и растворенный в нем глинозем. Электролит с 3 и 5% растворенного глинозема имеет температуру начала кристаллизации соответственно на 16 и 28оС ниже, чем у чистого криолита. Существенно снижается плотность электролита. Растворенный глинозем изменяет удельное электрическое сопротивление электролита, повышает его вязкость. Так, при введении в криолит 10% глинозема вязкость расплава возрастает на ~ 23%. Что касается электрического сопротивления электролита, то при повышении концентрации Al2O3 от нуля до 3,5% оно снижается. Дальнейшее повышение концентрации Al2O3 вызывает рост удельного сопротивления.
При больших концентрациях глинозема в электролите вновь поступающие порции Al2O3 могут превысить пороговую концентрацию и попадать в осадок, образовывая осадки и подовые настыли. Особенно это опасно для кислых и модифицированных электролитов с высоким содержанием CaF2 + MgF2. Поэтому превышение концентрации глинозема более 7-8% не считается целесообразным. Более того, риск образования осадков требует организации работы электролизеров на стабильно пониженной концентрации глинозема.
Таким образом, применяемые в практической металлургии алюминия составы электролита весьма разнообразны в зависимости от тех или иных технологических условий и особенностей конструкции электролизеров. По трактовке К.Гротхейма и Х.Кванде составы промышленных электролитов можно классифицировать на три группы:
- традиционные или классические электролиты с избытком AlF3 в пределах 3-7% (масс.) или к.о. = 2,5-2,8;
- модифицированные электролиты с введенными добавками CaF2, MgF2, LiF и с избытком AlF3;
- кислые электролиты с избытком AlF3 8-14% (масс.) или к.о. = 2,15-2,45.
Возможна комбинация кислых и модифицированных электролитов, что требует соблюдения целого ряда условий, перечисленных выше.
1.5. Процессы на аноде и катоде
В расплавленном виде криолит распадается на ионы Na+ и AlF63-, составляющие основу кристаллической решетки криолита:
Na3AlF6 ® 3Na+ + AlF63-
При низких концентрациях глинозема наиболее вероятно дальнейшее взаимодействие по реакции
4AlF63- + Al2O3 ® 3Al2OF84-
При высоких концентрациях глинозема, близких к насыщению, после ряда промежуточных реакций могут образоваться
соединения типа
AlF63- + Al2O3 ® 1,5Al2O2F42-
В расплавленном электролите промышленного электролизера в небольших количествах присутствуют также катионы Al3+, образующиеся за счет диссоциации анионов AlF63- и молекул AlF3.
В процессе электролиза положительные заряды переносятся к катоду преимущественно катионами Na+, содержащимися в наибольшем количестве в электролите, и в меньшей степени катионами алюминия Al3+, концентрация которых значительно ниже.
Однако катионы алюминия обладают меньшим потенциалом разряда, чем катионы Na+, поэтому на катоде будет происходить разряд катионов алюминия:
Al3+ + 3e- = Al
Катионы натрия не участвуют в процессе катодного разряда, что приводит к их накапливанию и образованию вблизи катода алюмината натрия:
Na+ + AlO2- = NaAlO2
Обогащение католита (часть электролита, находящегося вблизи катода) алюминатом натрия повышает вероятность одновременного разряда катионов Na+ и Al3+, что недопустимо по условиям технологии.
К аноду ток переносится анионами AlOF21-, Al2OF84-, Al2O2F42- и другими аналогичными анионами. Во время анодного процесса эти анионы теряют избыточные электроны, на аноде выделяется кислород, а электролит обогащается молекулами фтористого алюминия. Накопление фтористого алюминия в анолите приводит к преимущественному испарению его, а криолитовое отношение электролита повышается. Различие состава католита и анолита устраняется за счет естественного перемешивания электролита, которое происходит в результате температурной конвекции и перемешивающего воздействия анодных газов.
Участие ионов в процессе электролиза не следует смешивать с их участием в переносе тока. В нашем случае ток переносится одними ионами, присутствующими в больших концентрациях и обладающими повышенной подвижностью, а разряжаются на электродах другие ионы, обладающие более положительными (катионы) или более отрицательными (анионы) разрядными потенциалами.
Образующийся при электролизе первичный газ СО2 в виде пузырьков выходит из-под анода и взаимодействует с растворенным в электролите алюминием, а также с углеродом анода и угольной пены по реакциям
3CO2 + 2Al = Al2O3 + 3СO
CO2 + C = 2CO
За счет этих реакций анодный газ обогащается оксидом углерода СО. В электролизерах с самообжигающимися анодами содержание СО выше и составляет 50-55%, а с предварительно обожженными анодами - на 15-20% ниже. Это объясняется тем, что материал у обожженных анодов менее активен к реакции с СО2, т.к. они обожжены при температуре 1150±50оС, в то время как у самообжигающихся анодов - при 950-970ºС. Кроме того, ширина обожженного анода невелика и контакт газа с анодом сокращается. Применение в последние годы обожженных анодов со щелевыми прорезями, облегчающими эвакуацию анодных газов, дополнительно снижает продолжительность их контакта с анодом и увеличивает выход по току.
Содержание СО возрастает по мере увеличения температуры электролита, т.к. при этом повышается концентрация растворенного в электролите алюминия и ускоряется реакция окисления металла по приведенной выше реакции. С увеличением анодной плотности тока содержание СО в отходящем газе, напротив, снижается. Это объясняется возрастанием производительности электролизёра при одном и том же объёме реакций окисления и образования СО.
1.6. Побочные процессы на аноде и катоде
Анодный эффект
В ходе электролиза на аноде периодически возникает явление, называемое анодным эффектом или, по производственной терминологии, «вспышкой». Анодный эффект проявляется в прекращении нормального процесса электролиза с выделением анодных газов, в резком повышении электрического сопротивления на границе анод-электролит и сопровождается свечением множества электрических разрядов на этой границе. Сигналом начала вспышки служит свечение индикаторной лампочки на электролизёре и резкий скачок напряжения на вольтметре. Электролит быстро разогревается.
Наступлению анодного эффекта предшествует постепенное повышение рабочего напряжения на электролизёре. Оно начинается за 1-2 часа до вспышки и непосредственно перед вспышкой возрастает на 0,2-1,0 В. Природу анодного эффекта можно объяснить с позиции двух факторов: критической плотности тока и способности электролита смачивать поверхность анода.
Если на электролизёре с угольным анодом повышать силу (плотность) тока от нуля до определенного значения Iк, то вначале напряжение также будет равномерно возрастать в соответствии с законом Ома: U = IR, при том, что сопротивление R = const. При определенной плотности тока возникает резкий скачок напряжения, на границе анод-электролит образуются электрические разряды, а процесс электролиза прекращается. Это означает наступление анодного эффекта.
В этой связи принято понятие критической плотности тока, т.е. такой максимальной плотности тока на аноде, выше которой наступает анодный эффект.
Другой фактор – смачивание анодной поверхности электролитом. Этот фактор проявляется, главным образом, через зависимость смачивания от концентрации глинозема. Когда концентрация Al2O3 в электролите уменьшается до 1,0-1,5% и ниже, смачивание угольной поверхности резко снижается. Оксиды, в том числе и Al2O3, являются поверхностно-активными веществами и с уменьшением их концентрации смачивание угольной поверхности электролитом резко снижается. На поверхности анода образуется газовая пленка, отделяющая анод от электролита. Граничное электрическое сопротивление при этом резко возрастает.
С учётом этих двух факторов механизм возникновения анодного эффекта находит следующее объяснение. При снижении концентрации глинозема до 1,0-1,5% и ниже часть поверхности анода перестает смачиваться электролитом и процесс электролиза переносится на отдельные локальные участки. Постепенно площадь анодного процесса сокращается, а плотность тока на этих локальных участках возрастает и достигает критической. Далее следует анодный эффект.
Прохождение электрического тока от анода к электролиту во время вспышки осуществляется за счет плазмы электрических дуг разряда. В результате скачка электрического потенциала во время вспышки на аноде начинается разряд ионов фтора с образованием соединений фтористого углерода типа CF4, C2F6.
Электрические разряды локализуются на выступах и неровностях подошвы анода, т.е. там, где сопротивление прохождению тока минимально. В этих местах идет интенсивное срабатывание анода и тем самым его выравнивание.
На ваннах, работающих с большей анодной плотностью тока, анодный эффект будет возникать при большей концентрации Al2O3
Дата добавления: 2016-06-18; просмотров: 9006;











