Вопрос 1.Основные положения МКТ.
I положение:
Все тела (вещества) состоят из частиц (молекул, атомов, ионов...), между которыми есть промежутки. Опытные обоснования:- крошение вещества
- испарение жидкостей- смешивание веществ; диффузия- фотографии туннельного микроскопа
II положение Частицы находятся в постоянном, беспорядочном (хаотичном) движении (тепловое движение).Опытные обоснования: испарение (вылет частиц с поверхности вещества) диффузия
III положение
Частицы вещества взаимодействуют друг с другом: притягиваются на небольших расстояниях и отталкиваются, когда эти расстояния уменьшаются.
Вопрос 2. Размеры молекул.Многие опыты показывают, что размер молекулы очень мал. С помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10 в -8 степени см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см. Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Вопрос 3. Броуновское движение. Бро́уновское движе́ние — беспорядочное движение микроскопических видимых взвешенных в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа. Броуновское движение никогда не прекращается. Оно связано с тепловым движением, но не следует смешивать эти понятия.
Вопрос 4. Силы взаимодействия молекул.На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров молекулы притяжение максимально), на малых расстояниях сила отталкивания. Существует такое расстояние между молекулами , на котором силы притяжения становятся равными силам отталкивания.
Вопрос 5. Строение газообразных, жидких и твердых тел. ГАЗЫ Расстояние между атомами или молекулами в газах в среднем во много раз больше размеров самих молекул. Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга. Молекулы движутся с огромными скоростями — сотни метров в секунду. Сталкиваясь, они отскакивают друг от друга в разные стороны. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа. ЖИДКОСТИ Молекулы жидкости расположены почти вплотную друг к другу, , как в “клетке”, другими молекулами, она колеблется около положения равновесия, сталкиваясь с соседними молекулами. Лишь время от времени она совершает “ прыжок”, прорываясь сквозь “прутья клетки”, но тут же попадает в новую клетку, образованную новыми соседями. При попытке изменить объем жидкости начинается деформация самих молекул, для этого нужны очень большие силы. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы, они принимают форму сосуда.

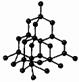 ТВЁРДЫЕ ТЕЛА. Атомы или молекулы твердых тел в отличие от атомов и молекул жидкостей колеблются около определенных положений равновесия. Правда, иногда молекулы меняют положение равновесия, но происходит это редко. Вот почему твердые тела сохраняют не только объем, но и форму. Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической. На рисунках изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
ТВЁРДЫЕ ТЕЛА. Атомы или молекулы твердых тел в отличие от атомов и молекул жидкостей колеблются около определенных положений равновесия. Правда, иногда молекулы меняют положение равновесия, но происходит это редко. Вот почему твердые тела сохраняют не только объем, но и форму. Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической. На рисунках изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Вопросы для самоконтроля
1.Сформулируйте основные положения МКТ.
2.Размеры наиболее крупных атомов и молекул.
3.Сравнение с обычными размерами.
4.Броуновское движение.
5.Оценка вил взаимодействия молекул.
6.Строение жидкостей, газов и твердых тел.
Тема 13:Газовые законы
План:
- Идеальный газ.
- Основное уравнение МКТ.
- Температура и ее измерение.
- Газовые законы.
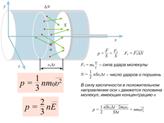
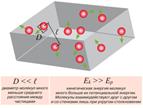 Вопрос 1. Идеальный газ.Идеальный газ – газ, атомы которого находятся на очень больших расстояниях и практически не взаимодействуют. Идеальный газ − газ, для которого взаимодействием и размерами молекул можно пренебречь. При достаточном разрежении (например, воздух при обычных, близких к нормальным условиям) газы с хорошей точностью описываются этой моделью. Молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Вопрос 1. Идеальный газ.Идеальный газ – газ, атомы которого находятся на очень больших расстояниях и практически не взаимодействуют. Идеальный газ − газ, для которого взаимодействием и размерами молекул можно пренебречь. При достаточном разрежении (например, воздух при обычных, близких к нормальным условиям) газы с хорошей точностью описываются этой моделью. Молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Вопрос 2. Основное уравнение МКТ.Основное уравнение молекулярно-кинетической теории газов связывает микро- и макропараметры, характеризующие газовую систему:
Вопрос 3. Температура и ее измерение.Температура – это степень нагретости тел. Температура — это физическая величина, которая является количественной мерой средней энергии теплового движения молекул газа. Действие приборов для измерения температуры базируется на различных физических эффектах. Наиболее распространены жидкостные (спиртовые и ртутные) термометры, в основе действия которых лежит тепловое расширение жидкостей. Есть также термометры газовые (термометры давления),электрические(термометры сопротивления) и др.
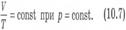
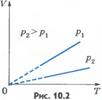

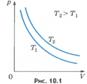
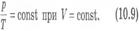 Вопрос 4. Газовые законы.Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческого слова «барос» - вес) Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.:
Вопрос 4. Газовые законы.Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческого слова «барос» - вес) Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.: 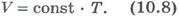 Эта зависимость графически изображается прямой, которая называется изобарой Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (от греческого слова «хорема» - вместимость). Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Согласно уравнению (10.9) давление газа при постоянном объеме пропорционально температуре:
Эта зависимость графически изображается прямой, которая называется изобарой Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (от греческого слова «хорема» - вместимость). Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Согласно уравнению (10.9) давление газа при постоянном объеме пропорционально температуре: 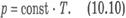 Эта зависимость изображается прямой, называемой изохорой
Эта зависимость изображается прямой, называемой изохорой
Вопросы для самоконтроля
1. Что такое идеальный газ?
2. Свойства.
3. Определение идеального газа.
4. Основное уравнение МКТ.
5. Что такое температура?
6. Единицы измерения температуры.
7. Газовые законы.
Тема 14:Основы термодинамики
План:
- Внутренняя энергия системы.
2. Работа в термодинамике.
3. Количество теплоты. Уравнение теплового баланса.
4. Первый закон термодинамики.
5. Второй закон термодинамики.
6. Принцип действия тепловых двигателей. КПД.
Вопрос 1. Внутренняя энергия системы.Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. Энергия упорядоченного движения частиц тела представляет собой механическую кинетическую энергию тела.
Вопрос 2. Работа в термодинамике. В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается равной нулю.
Вопрос 3. Количество теплоты. Уравнение теплового баланса. Количество теплоты – количественная мера изменения внутренней энергии тела. Уравнение теплового баланса характеризует процессы происходящие при теплообмене в замкнутой системе. Энергию, которую тело получает или отдаёт в процессе теплообмена, называют количеством теплоты (Q). Количество теплоты, как и все другие виды энергии, измеряется в системе СИ в Джоулях: [Q] = Дж. При нагревании или охлаждении тела количество теплоты, поглощаемое или выделяемое им, рассчитывается по формуле: Q = сm(t2 –t1),где m – масса тела, кг;(t2 – t1) – разность температур тела,° С (или К);с – удельная теплоёмкость вещества, из которого состоит тело, 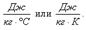 Удельная теплоёмкость вещества– это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1° С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1° С).
Удельная теплоёмкость вещества– это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1° С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1° С).
Вопрос 4. Первый закон термодинамикиЭнергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
Вопрос 5. Второй закон термодинамики – указывает направление всевозможных энергетических процессов. Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает. Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
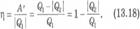 Вопрос 6. Принцип действия тепловых двигателей. КПД. Тепловые двигатели совершают работу за счет внутренней энергии топлива. КПД определяет отношение произведенной работы к количеству теплоты, переданного системе. Для того чтобы двигатель совершал работу, необходима разность давлений по обе стороны поршня двигателя или лопастей турбины. Во всех тепловых двигателях эта разность давлений достигается за счет повышения температуры рабочего тела (газа) на сотни или тысячи градусов по сравнению с температурой окружающей среды. Такое повышение температуры происходит при сгорании топлива. КПДНевозможность полного превращения внутренней энергии газа в работу тепловых двигателей обусловлена необратимостью процессов в природе. Если бы тепло могло самопроизвольно возвращаться от холодильника к нагревателю, то внутренняя энергия могла бы быть полностью превращена в полезную работу с помощью любого теплового двигателя.Коэффициентом полезного действия (КПД) теплового двигателяназывают отношение работы A´, совершаемой двигателем, к количеству теплоты, полученной от нагревателя:
Вопрос 6. Принцип действия тепловых двигателей. КПД. Тепловые двигатели совершают работу за счет внутренней энергии топлива. КПД определяет отношение произведенной работы к количеству теплоты, переданного системе. Для того чтобы двигатель совершал работу, необходима разность давлений по обе стороны поршня двигателя или лопастей турбины. Во всех тепловых двигателях эта разность давлений достигается за счет повышения температуры рабочего тела (газа) на сотни или тысячи градусов по сравнению с температурой окружающей среды. Такое повышение температуры происходит при сгорании топлива. КПДНевозможность полного превращения внутренней энергии газа в работу тепловых двигателей обусловлена необратимостью процессов в природе. Если бы тепло могло самопроизвольно возвращаться от холодильника к нагревателю, то внутренняя энергия могла бы быть полностью превращена в полезную работу с помощью любого теплового двигателя.Коэффициентом полезного действия (КПД) теплового двигателяназывают отношение работы A´, совершаемой двигателем, к количеству теплоты, полученной от нагревателя:
Вопросы для самоконтроля
1. Внутренняя энергия в молекулярно-кинетической энергии.
2. Работа в термодинамике.
3. Количество теплоты
4. Уравнение теплового баланса.
5. Первый закон термодинамики
6. Второй закон термодинамики .
7. Тепловой двигатель.
8. КПД теплового двигателя.
Тема 15:Свойства паров
План:
1. Насыщенный пар и его давление.
2. Влажность воздуха.
Вопрос1. Насыщенный пар и его давление.Насыщенный пар.
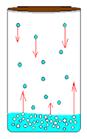 Если сосуд с жидкостью плотно закрыть, то сначала количество жидкости уменьшится, а затем будет оставаться постоянным. При неизменной температуре система жидкость - пар придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго. Одновременно с процессом испарения происходит и конденсация, оба процесса в среднем компенсируют друг друга. В первый момент, после того как жидкость нальют в сосуд и закроют его, жидкость будет испаряться и плотность пара над ней будет увеличиваться. Однако одновременно с этим будет расти и число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число его молекул возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре установится динамическое (подвижное) равновесие между жидкостью и паром, т. е. число молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкость. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Что будет происходить с насыщенным паром, если уменьшить занимаемый им объем? При сжатии пара равновесие начнет
Если сосуд с жидкостью плотно закрыть, то сначала количество жидкости уменьшится, а затем будет оставаться постоянным. При неизменной температуре система жидкость - пар придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго. Одновременно с процессом испарения происходит и конденсация, оба процесса в среднем компенсируют друг друга. В первый момент, после того как жидкость нальют в сосуд и закроют его, жидкость будет испаряться и плотность пара над ней будет увеличиваться. Однако одновременно с этим будет расти и число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число его молекул возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре установится динамическое (подвижное) равновесие между жидкостью и паром, т. е. число молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкость. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Что будет происходить с насыщенным паром, если уменьшить занимаемый им объем? При сжатии пара равновесие начнет  нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а значит, и концентрация его молекул не примут прежних своих значений. Следовательно, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема. Давление pн.п. пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара. Зависимость давления насыщенного пара от температуры. Состояние насыщенного пара, приближенно описывается уравнением состояния идеального газа, а его давление определяется формулой Р = nкТ С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры. С увеличением температуры давление реального насыщенного пара растет быстрее, чем давление идеального газа Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре
нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а значит, и концентрация его молекул не примут прежних своих значений. Следовательно, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема. Давление pн.п. пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара. Зависимость давления насыщенного пара от температуры. Состояние насыщенного пара, приближенно описывается уравнением состояния идеального газа, а его давление определяется формулой Р = nкТ С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры. С увеличением температуры давление реального насыщенного пара растет быстрее, чем давление идеального газа Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре

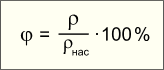 Вопрос 2. Влажность воздуха.В окружающем нас воздухе практически всегда находится некоторое количество водяных паров. Влажность воздуха зависит от количества водяного пара, содержащегося в нем. Сырой воздух содержит больший процент молекул воды, чем сухой. Большое значение имеет относительная влажность воздуха. Относительная влажность — это отношение плотности водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной температуре, выраженное в процентах
Вопрос 2. Влажность воздуха.В окружающем нас воздухе практически всегда находится некоторое количество водяных паров. Влажность воздуха зависит от количества водяного пара, содержащегося в нем. Сырой воздух содержит больший процент молекул воды, чем сухой. Большое значение имеет относительная влажность воздуха. Относительная влажность — это отношение плотности водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной температуре, выраженное в процентах
Точка росы.Сухость или влажность воздуха зависит от того, насколько близок его водяной пар к насыщению. Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться. Температура, при которой пар, находящийся в воздухе, становится насыщенным, называется точкой росы. Примеры: выпадение росы под утро, запотевание холодного стекла, если на него подышать, образование капли воды на холодной водопроводной трубе, сырость в подвалах домов. Для измерения влажности воздуха используют измерительные приборы - гигрометры.
Вопросы для самоконтроля
1. Определение влажности воздуха.
2. Что такое испарение?
3. Что такое конденсация. Примеры.
4. Что такое насыщенный пар?
Тема 16:Свойства жидкостей
План:
1. Жидкое состояние вещества.
2. Поверхностное натяжение.
3. Капиллярные явления.
Вопрос 1. Жидкое состояние вещества.Взаимодействия между частицами вещества в жидком состоянии достаточно сильны, чтобы препятствовать беспорядочному перемещению частиц, но все же недостаточны для прекращения их перемещения друг относительно друга. Поэтому, подобно твердому телу, жидкость обладает определенной структурой. По структуре жидкое состояние является промежуточным между твердым состоянием со строго определенной периодической структурой во всем кристалле и газом, в котором какая-либо структура полностью отсутствует. Для жидкости характерно наличие определенного объема и отсутствие определенной формы.
Первое обстоятельство сближает жидкости с твердыми телами, второе – с газами. У жидкости вблизи температуры замерзания упорядоченность внутренней структуры становится более четко выраженной, наоборот, по мере приближения к температуре кипения усиливается беспорядок во взаимном расположении частиц.
Структура и физические свойства жидкостей зависят от химической индивидуальности образующих её частиц и от характера и интенсивности сил, действующих между ними. Для полярных молекул большую роль играют ориентационные взаимодействия и водородные связи. У неполярных – дисперсионные взаимодействия. Рассмотрим некоторые свойства жидкостей. Они имеют определенную форму и объем, плотность жидкости намного больше, чем плотность газа. В общем случае плотность жидкости подобна плотности твердых тел. Сжимаемость жидкости очень невелика, поскольку между частицами жидкости остается очень мало свободного пространства.
Вопрос 2. Поверхностное натяжение.Силы притяжения между молекулами на поверхности жидкости удерживают их от движения за ее пределы. Молекулы жидкости испытывают силы взаимного притяжения — на самом деле, именно благодаря этому жидкость моментально не улетучивается.
 Вопрос 3. Капиллярные явления.В природе часто встречаются тела, имеющие пористое строение (пронизаны множеством мелких каналов). Такую структуру имеют бумага, кожа, дерево, почва, многие строительные материалы. Вода или другая жидкость, попадая на такое твердое тело, может впитываться в него, поднимаясь вверх на большую высоту. Так поднимается влага в стеблях растений, керосин поднимается по фитилю, ткань впитывает влагу. Такие явления называются капиллярными. В узкой цилиндрической трубке смачивающая жидкость за счет сил молекулярного взаимодействия поднимается вверх, принимая вогнутую форму. Под вогнутой поверхностью появляется дополнительное давление, направленное вверх, в связи с чем уровень жидкости в капилляре выше уровня свободной поверхности. Несмачивающая же жидкость принимает выпуклую поверхность. Под выпуклой поверхностью жидкости возникает обратное дополнительное давление, направленное вниз, так что уровень жидкости с выпуклым мениском ниже, чем уровень свободной поверхности.
Вопрос 3. Капиллярные явления.В природе часто встречаются тела, имеющие пористое строение (пронизаны множеством мелких каналов). Такую структуру имеют бумага, кожа, дерево, почва, многие строительные материалы. Вода или другая жидкость, попадая на такое твердое тело, может впитываться в него, поднимаясь вверх на большую высоту. Так поднимается влага в стеблях растений, керосин поднимается по фитилю, ткань впитывает влагу. Такие явления называются капиллярными. В узкой цилиндрической трубке смачивающая жидкость за счет сил молекулярного взаимодействия поднимается вверх, принимая вогнутую форму. Под вогнутой поверхностью появляется дополнительное давление, направленное вверх, в связи с чем уровень жидкости в капилляре выше уровня свободной поверхности. Несмачивающая же жидкость принимает выпуклую поверхность. Под выпуклой поверхностью жидкости возникает обратное дополнительное давление, направленное вниз, так что уровень жидкости с выпуклым мениском ниже, чем уровень свободной поверхности.
Адсорбция - явление аналогичное смачиванию, наблюдается при соприкосновении твердой и газообразной фаз. Если силы взаимодействия между молекулами твердого тела и газа велики, то тело покрывается слоем молекул газа. Большой адсорбционной способностью обладают пористые вещества. Свойство активированного угля адсорбировать большое количество газа используют в противогазах, в химической промышленности, в медицине.
Опыт со стаканом и тряпкой.
Вопросы для самоконтроля
1.Дать определение жидкости.
2.Что такое поверхностное натяжение.
3.Как капиллярные явления меняют нашу жизнь?
4.Значение капиллярных явлений. Примеры.
Тема 17:Механические свойства твердых тел
План:
1. Характеристика твердого состояния вещества.
2. Упругие свойства твердых тел. Закон Гука.
3. Тепловое расширение твердых тел и жидкостей.
4. Плавление и кристаллизация.
Вопрос 1. Характеристика твердого состояния вещества. Исследования древних ученных. Характеристика твердого состояния вещества с молекулярной точки зрения. Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Различают кристаллические и аморфные твёрдые тела.
Вопрос 2.Упругие свойства твердых тел. Закон Гука. Определение. Формула Примеры. Деформации. Виды деформаций с точки зрения МКТ. Силы притяжения и отталкивания обуславливают механическую прочность твердых тел. т. е. их способность противодействовать изменению формы и объема. Растяжению тел препятствуют силы межатомного притяжения, а сжатию - силы отталкивания. Не деформируемых тел в природе не существует.
Деформация - изменение формы или объема тела под действием внешних сил. Деформация может быть упругая или неупругая. Упругаядеформация - деформация, при которой после прекращения действия силы размеры и форма тела восстанавливаются.
Виды деформаций:Линейная: Растяжение (тросы подъемных кранов, канатных дорог, буксирные тросы)Сжатие (колонны, стены, фундаменты зданий). Сдвиг (заклепки, болты, соед. металлические конструкции, процесс разрезания ножницами бумаги).Кручение (завинчивание гаек, работа валов машин, сверление металлов и т.п.).Изгиб (формально деформация растяжения и сжатия, различная в разных частях тела. Нейтральный слой - слой, не подвергающийся ни растяжению, ни сжатию, при изгибе.)
Вопрос 3. Тепловое расширение твердых тел и жидкостей.Тепловое расширение (также используется термин "термическое расширение") — изменение линейных размеров и формы тела при изменении его температуры. Количественно тепловое расширение жидкостей и газов при постоянном давлении характеризуется изобарным коэффициентом расширения (объёмным коэффициентом теплового расширения).Примеры из жизни и профессии.
Вопрос 4. Плавление и кристаллизация.Молекулярная физика. Плавление и кристаллизация. Переход вещества из жидкого состояния в кристаллическое называется кристаллизацией .Это процесс, обратный плавлению. Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой плавления. Пока происходит кристаллизация, температура вещества не изменяется. Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Например, у льда Сtпл=00С.Пока происходит плавление, температура вещества не изменяется. Примеры из жизни и профессии.
Вопросы для самоконтроля
1.Характеристика твердого состояния вещества.
2.Упругие свойства твердых тел.
3.Что такое деформации?
4.Виды деформаций.
5.Дать определение Закона Гука.
6.Тепловое расширение твердых тел и жидкостей. Сравнение.
7. Плавление и кристаллизация. Примеры в жизни, профессии
Тема 18:Электрические заряды. Закон сохранения заряда
План:
1. Электрические заряды.
2. Закон сохранения заряда.
3. Закон Кулона.
4. Единица электрического заряда.
Вопрос 1. Электрические заряды. Два вида зарядов. Положительные и отрицательные. В определенных условиях на телах могут накапливаться электрические заряды. Электрический заряд – физическая величина, определяющая свойство частиц или тел вступать в электромагнитные силовые взаимодействия. Опытным путем установлено, что существуют электрические заряды двух типов; один из них условно назван положительным, а второй – отрицательным. Электризация тел тесно связана со строением молекул и атомов, из которых состоят вещества. В частности, атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов; электризация тел объясняется избытком или недостатком электронов в наэлектризованном теле. С современной точки зрения, носителями зарядов являются элементарные частицы – протоны и электроны.
Как взаимодействуют. Примеры получения электрических зарядов. Единица измерения –Кулон (Кл)
Вопрос 2. Закон сохранения заряда. Полный заряд Вселенной равен нулю (количество положительных зарядов равно количеству отрицательных)
Закон сохранения заряда утверждает, что во время взаимодействия некоторой замкнутой системы с окружающим пространством количество заряда которое выходит из системы через ее поверхность равно количеству заряда поступившего внутрь системы. Другими словами алгебраическая сумма всех зарядов системы равна нулю. 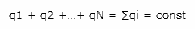
Как известно в природе существует два вида зарядов. Это положительные и отрицательные. Также величина заряда дискретна, то есть он может меняться только порциями. Элементарным зарядом считается заряд электрона. Если к атому добавить один электрон, то он становится отрицательно заряженным ионом. А если его отнять то положительным. Основная идея закона сохранения заряда состоит в том, что заряд не возникает из неоткуда и не исчезает в никуда. При возникновении заряда одного знака тут же появляется заряд противоположного знака той же величины.
Дата добавления: 2020-02-05; просмотров: 910;











