Работа и теплота как функции процесса
Предположим, что имеем цилиндр с поршнем. В запоршневом пространстве находится рабочее тело. К рабочему телу подводится тепло в результате чего рабочее тело может расшириться.
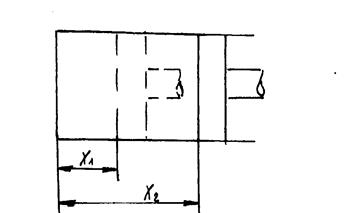 Сила P действующая со стороны рабочего тела на поршень равна
Сила P действующая со стороны рабочего тела на поршень равна
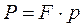
где F – площадь поршня.
Рис. 2.2. К определению работы совершаемой рабочим телом.
При бесконечно малом перемещении поршня на расстояние dx будет совершена элементарная работа dL
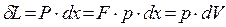 (2.9)
(2.9)
где 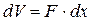 - элементарное изменение объёма рабочего тела.
- элементарное изменение объёма рабочего тела.
Тогда полная работа при перемещении поршня определится выражением

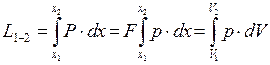 (2.10)
(2.10)
Как видно из выражения (2.10) работа, совершаемая рабочим телом, зависит от характера изменения давления в процессе движения поршня.
Разделив выражения (2.9) и (2.10) на массу рабочего тела G , получим выражение для удельной работы
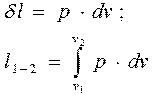
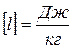 (2.11)
(2.11)
Сопоставляя выражение (2.11) и диаграмму (а) на рис.2.1 видим, что работа графически выражается площадью над кривой процесса в ( - ) диаграмме.
Используя выражение (2.6) и (2.7) можем записать
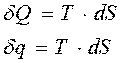 (2.12)
(2.12)
Интегрируя последние выражения от начального состояния (1) до конечного состояния (2) получим соответственно:
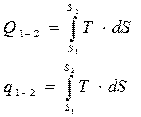 (2.13)
(2.13)
Как видно из выражения (2.13) полное и удельное тепло подведённое (отведённое) к рабочему телу зависит от вида функции T (S ), т.е. зависит от характера процесса.
Таким образом очевидно, что работа и тепло не являются функциями состояния, а являются функциями процесса.
Теплоёмкость.
Способность рабочих тел поглощать тепло характеризуется теплоёмкостью.
Теплоёмкость тела C численно равна количеству тепла, которое нужно подвести к рабочему телу, чтобы нагреть его на один градус.
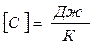
Удельная теплоёмкость численно равна количеству тепла, которое необходимо подвести к единице количества вещества, чтобы нагреть его на один градус.
В зависимости от выбора единицы измерения количество вещества различают:
- на массовую теплоёмкость
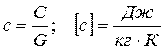
- на объёмную теплоёмкость
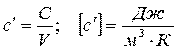
- на мольную теплоёмкость
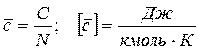
где N - количество молей вещества.
Используя соотношения между единицами измерения количества вещества, можно записать
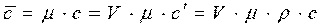
где m - молекулярная масса вещества 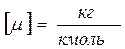
Vm - мольный объём 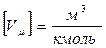
r - плотность вещества кг/м3 .
Теплоемкости газа в различных термодинамических процессах (расширение сжатие с подводом или отводом тепла) могут меняться в очень широких пределах. Особое значение в технической термодинамике занимают процессы при постоянном объёме V=const и постоянном давлении p=const и соответствующие им теплоёмкости:
- при постоянном объёме - 
- при постоянном давлении 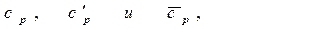
Теплоёмкости cp и cV связаны между собой известным уравнением Майера
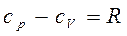 (2.14)
(2.14)
т.е. величина cp всегда больше величины cV на величину работы, совершаемой газом при нагревании на 1° при p=const.
Для определения удельной теплоёмкости экспериментальным путём к определённому количеству газа массой G подводится определённое количество тепла Q, при этом газ нагревается от температуры t1 до t2. Удельная теплоёмкость определяется по зависимости
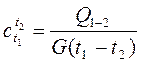 (2.15)
(2.15)
Определённая таким образом теплоёмкость является средней в заданном диапазоне температур t1 ¸ t2.
Каждая из ранее рассматриваемых теплоёмкостей зависит от температуры, поэтому для определения истинного значения теплоёмкости, соответствующей данной температуре t, необходимо, чтобы при измерениях t2®t1 тогда истинная теплоёмкость определится выражением
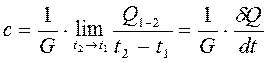 (2.16)
(2.16)
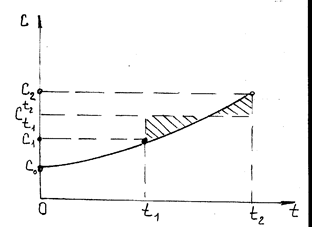
Характерный вид зависимости c(t) представлен на рис.2.3.
Обычно аналитическое выражение зависимости c(t) представляется в виде полиномиального ряда
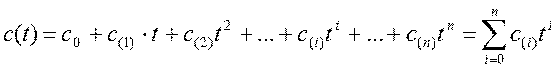
 |
Значения c(t) для различных веществ приводятся в справочной литературе.
При известной зависимости c(t), количество тепла Q необходимое, что-бы нагреть массу рабочего тела G от температуры t2 до температуры t1, определится зависимостью
|
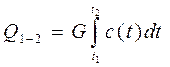 (2.17)
(2.17)
или при нагревании I кг газа
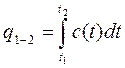 (2.17.а)
(2.17.а)
Во многих термодинамических процессах температура рабочего тела меняется в довольно ограниченных пределах, при этом удельная теплоёмкость меняется незначительно. В таких случаях, для упрощения аналитических выкладок и сокращения расчётных процедур удельную теплоёмкость в заданном диапазоне температур t1 ¸ t2, полагают постоянной величиной, равной некоторому среднему значению.
Тогда, положив в (2.17) и (2.17.а) 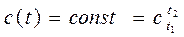 получим
получим
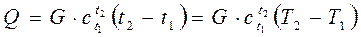 (2.18)
(2.18)
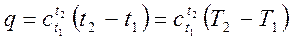 (2.18.a)
(2.18.a)
Для нахождения 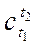 по известной зависимости c(t) и заданному диапазону температур t1 ¸ t2, приравняем выражения (2.17) и (2.18) и найдём
по известной зависимости c(t) и заданному диапазону температур t1 ¸ t2, приравняем выражения (2.17) и (2.18) и найдём
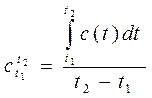
 (2.19)
(2.19)
Для упрощения процедуры нахождения 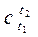 в справочниках часто приводят значения средних теплоёмкостей от 0° С до отдельных значений – ti. Такие данные представляют таблицей
в справочниках часто приводят значения средних теплоёмкостей от 0° С до отдельных значений – ti. Такие данные представляют таблицей
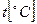
| t1 | T2 | . . . . . . . | ti | . . . . . . . | tn | |
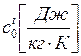
| C0 | 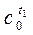
| 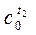
| . . . . . . . | 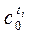
| . . . . . . . | 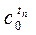
|
Для нахождения средней теплоёмкости в диапазоне t1 ¸ t2 вычислим количество тепла, которое необходимо подвести I кг газа, чтобы нагреть его от 0 °С до t2 °С и от 0° до t1 °С.
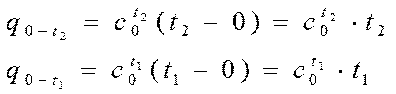
Очевидно, что количество тепла 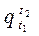 , которое необходимо, чтобы нагреть 1 кг газа от t1 °Сдо t2 °С будет равно разности
, которое необходимо, чтобы нагреть 1 кг газа от t1 °Сдо t2 °С будет равно разности
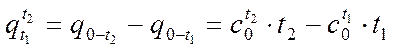 (а)
(а)
Приравняв (2.18.а) и (а) найдём
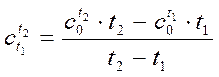 (2.20)
(2.20)
* При анализе 2ого закона термодинамики будет доказано, что S - является функцией состояния, т.е. dS - полный дифференциал.
Дата добавления: 2018-11-26; просмотров: 1576;











