Сопряжение (p,p и р,p). Энергия сопряжения. Сопряженные системы с открытой и замкнутой цепью сопряжения (вопр. 6): строение, устойчивость, примеры.
В случае локализованной ковалентной связи связывающая молекулярная орбиталь принадлежит двум атомам и является двухцентровой и двухэлектронной. Если же одна или более связывающих орбиталей охватывают три или даже большее число ядер, то в этом случае говорят о делокализованной связи. Делокализованная связь — это ковалентная связь, молекулярные орбитали которой охватывают более двух атомов. Характерна для соединений, содержащих открытые или замкнутые системы сопряжения.
р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя общую π-электронную систему. Такой особый вид взаимного влияния атомов называется сопряжением. Сопряжение — это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных π-орбиталей. Делокализованные МО могут принадлежать двум или более л-связям, тогда такой тип сопряжения называют π,π-сопряжением. В сопряжении могут участвовать π-связь и соседний атом с р-орбиталью, тогда такой вид сопряжения называют р,π-сопряжением.
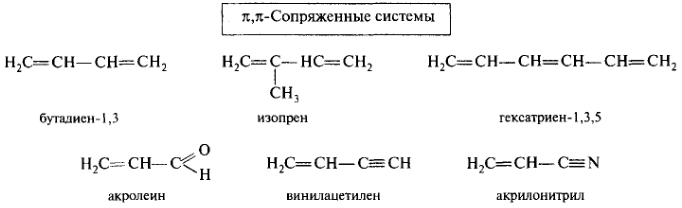
π,π-Сопряжение. Простейшим представителем π,π-сопряженных систем с углеродной цепью является бутадиен-1,3, в молекуле которого 12С находятся в состоянии sp2-гибридизации. Атомы 12С и 1Н в одной плоскости. Все σ-связи также лежат в этой плоскости, образуя σ-остов (σ-скелет). Расстояние между 12С, связанными двойной связью (0,134 нм), несколько больше длины С=С в этилене (0,133 нм), а длина связи С-2—С-3 (0,147 нм) явно короче связи С—С (0,154 нм) в этане. Негибридизованные р-орбитали каждого 12С перпендикулярны плоскости σ-скелета и параллельны друг другу, что создает условия для их взаимного перекрывания и образования единого π-электронного облака.
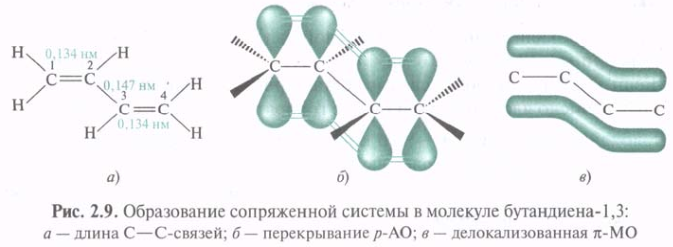
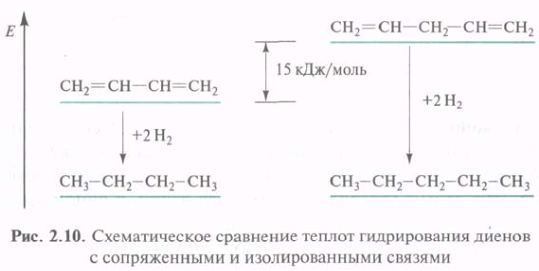
Дополнительное перекрывание р-АО, приводящее к делокализации π-электронов в сопряженной системе, сопровождается выделением энергии, поэтому сопряженные соединения обладают меньшим запасом энергии. Они стабильнее, чем соединения с изолированными кратными связями. Сопряженный диен более устойчив, чем несопряженный.
Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения (энергией делокализации). Для бутадиена-1,3 энергия сопряжения невелика (15 кДж/моль). Цепь сопряжения может включать большое число кратных связей, и в этом случае энергия сопряжения может стать значительной величиной. Чем больше цепь сопряжения, тем стабильнее соединение.
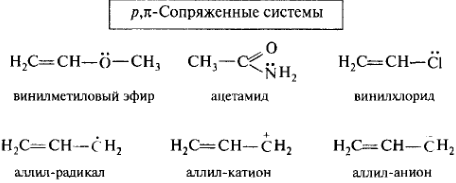
р,π-Сопряжение осуществляется в том случае, когда орбитали двойных (или тройных) π-связей перекрываются с р-орбиталью соседнего атома и образуется единая делокализованная система π-электронов. р,π-Сопряжение осуществляется в молекулах, содержащих фрагмент С=С—Ẍ, где X — гетероатом с свободной пару электронов на р-АО. Например, винилдиметиламин и дивиниловый эфир:
↑ 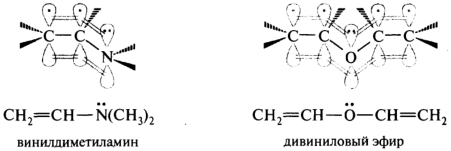
 ↓
↓
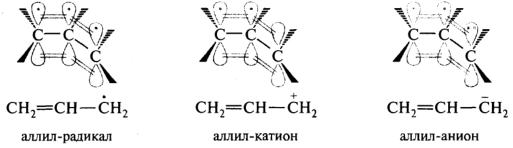
Участие 12С в р,π-сопряжении с кратной связью возможно только в том случае, если он превратится в радикал, катион или анион. При этом произойдет регибридизация такого атома из sp3- в sp2-состояние. Например, аллильные свободные радикалы, аллильные катионы и анионы. В аллильном радикале на р-АО 12С, сопрягающегося с двойной связью, находится 1 электрон; в аллильном катионе в сопряжение вступает вакантная р-орбиталь; в аллильном анионе 12С, несущий отрицательный заряд, поставляет в систему сопряжения два электрона. Делокализация электронной плотности в этих частицах приводит к их относительной стабильности.
Дата добавления: 2016-06-18; просмотров: 24577;











