Пространственное строение органических соединений: конфигурация, конформация; способы изображения; примеры.
Конфигурация молекул, в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах. Различия между конфигурациями молекул обусловливают существование двух видов устойчивых стереоизомеров — геометрических и оптических. Конфигурация молекулы не меняется при изменении её конформации, т. е. при повороте вокруг простых связей отдельных частей молекулы относительно друг друга.
Конформация определяется как любое относительное положение атомных ядер в молекуле, при котором сохраняется ее целостность (т. е. конфигурация). Конформационные изомеры, или конформации, неотделимы друг от друга и сосуществуют в едином множестве геометрических форм, возникающих в результате перемещения ядер атомов в молекуле относительно друг друга.
Деление стереоизомеров на конфигурационные и конформационные весьма условно. Дело в том, что до сих пор не выработано четкого критерия, позволяющего дифференцировать эти два фундаментальных стереохимических понятия. В одних условиях соединение может быть конфигурационно устойчивым, т. е. его можно считать конфигурационным стереоизомером, тогда как в другом температурном интервале оно же быстро превращается в другой стереоизомер и эту пару изомеров следует уже считать конформациями. Однако существуют конфигурационно устойчивые стереоизомеры, которые в традиционном понимании следовало бы считать конформерами.
Таким образом, можно привести в виде схемы обобщенную классификацию стереоизомеров, на которой показана четкая граница между понятиями «энантиомерия» и «диастереомерия» и нечеткое, размытое разделение понятий конфигурационных и конформационных стереоизомеров.
Для изображения пространственного строения молекул на плоскости применяют различные стереохимические и проекционные формулы. При работе с молекулярными моделями, передающими относительное расположение атомов в пространстве с помощью условных символов, достигается наибольшая наглядность представления о пространственном расположении атомов или атомных групп в молекулах. Существует несколько типов молекулярных моделей.
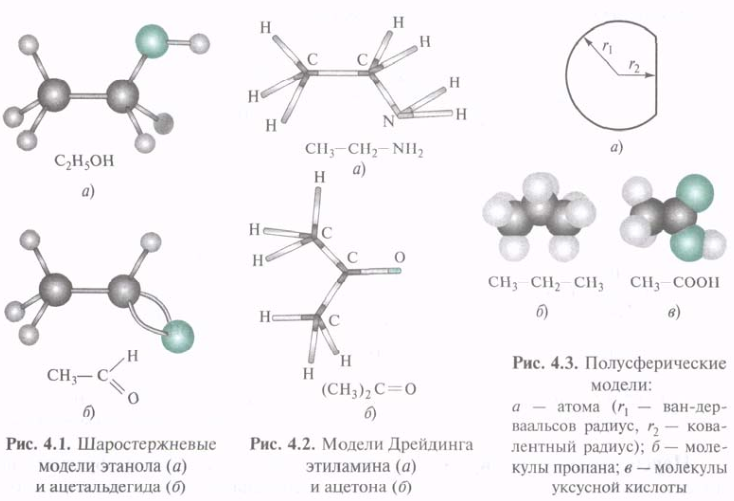
Шаростержневые модели. Модели этого типа собирают из цветных шариков, обозначающих входящие в состав молекул атомы. Шарики соединяют стержнями, символизирующими химические связи. С помощью шаростержневых моделей довольно точно воспроизводятся валентные углы в молекуле, но межъядерные расстояния отражаются лишь приблизительно, поскольку длины стержней, соединяющих шарики, не пропорциональны длинам связей. Существенный недостаток шаростержневых моделей заключается также в том, что они не создают картину заполнения межъядерного пространства электронной плотностью.
Модели Дрейдннга. Такие модели достаточно точно передают валентные углы и соотношение длин связей в молекулах. Ядра атомов в них, в отличие от шаростержневых моделей, обозначаются не шариками, а точками соединения стержней.
Полусферические модели. Эти модели, называемые также моделями Стюарта-Бриглеба, собирают из шаров со срезанными сегментами. Модели атомов соединяют между собой плоскостями срезов с помощью кнопок. Радиусы полусфер, соответствующие определенным атомам, пропорциональны их ван-дер-ваальсовым радиусам. Ван-дер-ваальсов радиус определяет пространство, которое в основном занимают валентные электроны. Кратчайшие расстояния от центров шаров до плоскостей срезов пропорциональны ковалентным радиусам r2 соответствующих атомов. Полусферические модели точно передают как соотношение длин связей и валентных углов, так и заполненность межъядерного пространства в молекулах. Однако эта заполненность не всегда позволяет получить наглядное представление о взаимном расположении ядер атомов в молекуле.
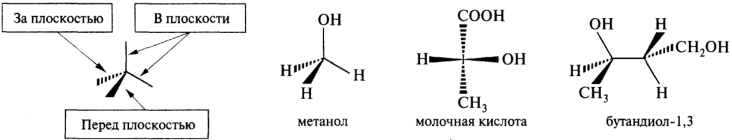
Стереохимические формулы. Их используют для изображения молекул, содержащих тетраэдрические и тригональные 12C, т. е. в sp3- и sp2-гибридном. При этом связи, располагающиеся в пространстве перед плоскостью чертежа, изображают утолщенными или клиновидными линиями, а связи, располагающиеся за плоскостью чертежа, — штриховыми линиями. Связи, которые находятся в плоскости чертежа, изображают сплошными линиями.
Проекционные формулы Ньюмена. Эти формулы применяют для изображения двухуглеродных фрагментов молекул. При построении проекции Ньюмена узловые атомы двухатомного (в частности, двухуглеродного) фрагмента располагают в пространстве так, чтобы они находились на одной линии с глазом наблюдателя, после чего ближний атом обозначают на бумаге точкой, а удаленный от наблюдателя атом — окружностью. Остальные связи изображают сплошными линиями под углом 120°.
Проекционные формулы Ньюмена можно использовать также применительно к многоатомным молекулам и циклическим структурам.
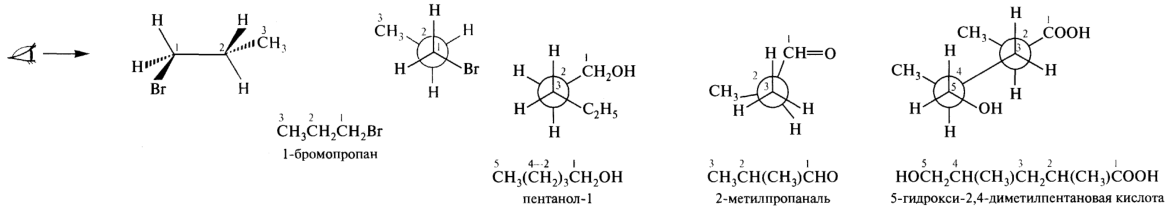
Перспективные формулы. Для изображения двухуглеродных фрагментов молекул используют также формулы типа лесопильных козел, представляющие собой перспективное изображение молекулярной модели с непропорционально удлиненной центральной связью.
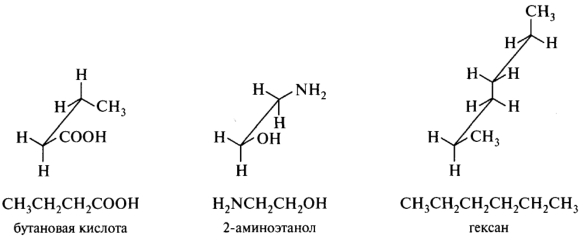
Проекционные формулы Фишера. С помощью этих формул изображают молекулы, имеющие в своем составе асимметрические атомы углерода. Для построения проекции Фишера молекулярную модель располагают так, чтобы связи, направленные к наблюдателю, образовывали на проекции горизонтальную линию. Тогда две другие связи будут удалены от наблюдателя и на проекции будут образовывать вертикальную линию. Это иллюстрируется примером построения проекционной формулы молочной кислоты: Аналогичным образом строят проекционные формулы молекул, имеющих более одного асимметрического атома углерода, как это видно на примере построения проекции Фишера для одного из стереоизомеров винной кислоты.
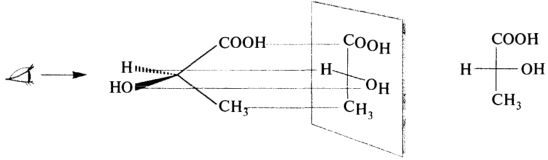
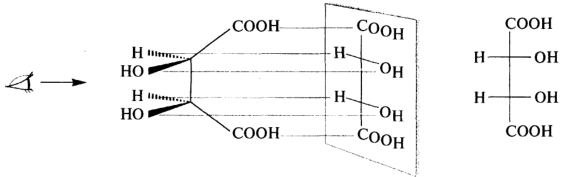
Иногда на проекционных формулах вертикальные линии изображают штриховой линией, что символизирует их положение за плоскостью. Когда приходится изменять положение проекционной формулы на плоскости, во избежание искажения стереохимического смысла преобразования проводят с соблюдением определенных правил:
· в проекционной формуле можно менять местами два любых заместителя у одного и того же асимметрического атома углерода четное число раз.
· проекционную формулу можно поворачивать в плоскости на 180°.
Несоблюдение этого порядка преобразований приводит к изменению стереохимического смысла проекционных формул (нечетное число перестановок приводит к формуле с противоположной конфигурацией).
Дата добавления: 2016-06-18; просмотров: 8078;











