Фізична хімія рідкої сталі
Речовина може перебувати в трьох різних станах – твердому, рідкому, газоподібному, а також у так званому четвертому стані – плазмі.
Теорія твердого стану сталі, якою займаються металознавці, розвинена набагато краще, ніж теорія її рідкого стану (через істотні температури останнього, що перешкоджає застосуванню сучасних способів вивчення будови рідкої сталі).
Порівнянням деяких фізичних властивостей сталі в твердому та рідкому станах (збільшення питомого об’єму в процесах плавлення та випарювання, прихована теплота плавлення та випарювання, теплоємність тощо) доведено: як і інші речовини сталь у рідкому стані ближча за структурою до твердої сталі, ніж до її випарів.
Розробку теорії рідкого стану речовин ще не завершено й існують різні його моделі. Не вдаючись у подробиці, можна визначити загальну для всіх теорій концепцію, що полягав в існуванні в рідині як хаотично розміщених атомів та молекул, так і мікроскопічних утворень певної будови, що нагадує будову твердого тіла речовини.
Отже, існує як ближній порядок будови рідини, тобто відповідні кількість та тип атомів і молекул, розмішених навколо кожного з них, так і дальній порядок, який полягав в продовженні певного порядку будови на скінченній відстані.
За допомогою рентгенівського випромінювання зіпсовано, що в рідкому залізі атоми заліза мають розмір 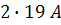 , а відстань між ними становить
, а відстань між ними становить 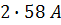 .
.
Координаційні числа 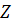 , тобто кількість атомів заліза, що оточують кожний із атомів, у твердому залізі такі:
, тобто кількість атомів заліза, що оточують кожний із атомів, у твердому залізі такі:
для: 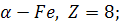
для: 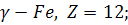
для: 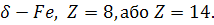
Водночас у рідкому залізі координаційне число коливається в межах 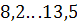 , тобто значною мірою відповідає його значенню в
, тобто значною мірою відповідає його значенню в 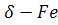 . Це є ще одним доказом аналогії в будовах рідкого та твердого станів речовини.
. Це є ще одним доказом аналогії в будовах рідкого та твердого станів речовини.
З’ясовано, що протяжність дальнього порядку в рідкому залізі, тобто розміри впорядкованої будови останнього, дорівнює від п’яти до восьми розмірів атома заліза, тобто 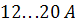 . Для цих утворень упорядкованої будови останнім часом найчастіше вживається термін «кластери».
. Для цих утворень упорядкованої будови останнім часом найчастіше вживається термін «кластери».
Кластери слід розглядати як утворення, межі яких у просторі змінюються щомиті. Атоми, що розміщуються на поверхні цих утворень, весь час відокремлюються і переходять до хаотичного стану існування. Водночас атоми, що перебували в хаотичному стані, приєднуються до кластерів. Причому кількість тих та інших однакова при умовах, в яких перебував рідке залізо. Чим вищою є температура заліза, тобто чим більшу енергію мають атоми, тим меншими є розміри кластера. Якщо до рідкого заліза підводиться якась енергія, наприклад механічна, що дисипується в рідині і підвищує енергоємність кластерів, то розмір кластерів також зменшується.
Сталь є розчином у залізі різних елементів, тому їй притаманні всі фізико-хімічні закономірності розчинів.
Елементи, з яких складається сталь, можуть створювати розчини типу заміщення та вкорінення. У першому випадку розчинюваність елемента в сталі необмежена, а в другому – обмежена.
Необмежено розчиняються в залізі, наприклад, марганець, кремній, алюміній, нікель, мідь, що в елементами-металами.
Існують відомості про обмежену розчиненість у залізі таких елементів-металів, як хром, ванадій, молібден, вольфрам, титан. Але в практиці сталеплавильного виробництва вміст цих елементів у переважній більшості випадків перебуває а межах, що забезпечують їх повну розчинність.
Майже зовсім не розчиняється в залізі свинець, а такі еле-менти-мет8ли, як магній і кальцій розчиняються обмежено, оскільки їх температура випарювання значно нижча за фактичну температуру рідкої сталі.
Елементи-металоїди – вуглець, сірка, фосфор, кисень, водень, азот – розчиняються в обмеженій кількості: 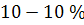 за порядком.
за порядком.
Вуглець утворює в сталі розчин вкорінення, що створює певне напруження в кристалічній решітці і спричинює підвищення твердості та міцності сталі.
Розчинюваність вуглецю в залізі залежить від температури та вмісту інших елементів. Насиченість вуглецем обчислюють за рівнянням:
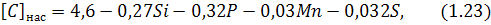
де вміст елементів обчислюють у відсотках, або за рівнянням:
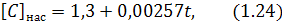
де температуру обчислюють у градусах Цельсія.
Кожний атом вуглецю в рідкому залізі оточений шістьма атомами заліза. У чавуні існують часточки графіту, цементиту 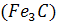 і катіони
і катіони 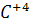
Межа між чавуном і сталлю пролягав близько 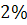 вуглецю, але лише деякі сталі містять до
вуглецю, але лише деякі сталі містять до 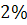 вуглецю. Концентрація вуглецю в переважній їх більшості нижча за
вуглецю. Концентрація вуглецю в переважній їх більшості нижча за 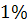 .
.
Розчин вуглецю в сталі реальний, тобто коефіцієнт активності відрізняється від нуля, а саме: перевищує нуль; отже, активність вуглецю в сталі перевищує його концентрацію.
Кремній створює в залізі розчин заміщення, який є реальним. На лінії ліквідує системи 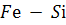 існує максимум, який відповідає сполуці
існує максимум, який відповідає сполуці 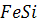 .
.
Марганець створює в залізі розчини заміщення, дуже близькі до ідеальних.
Хром створює в залізі розчини заміщення, що наближаються до ідеальних.
Фосфор створює в залізі розчин заміщення і в рідкому стані розчиняється в кількості, що перевищує звичайно присутню. На лінії ліквідує системи 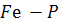 існує максимум, який відповідає сполуці
існує максимум, який відповідає сполуці 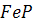 . Але при твердненні сталі розчинюваність істотно зменшується, що спричинює дифузію фосфору із зерна в міжзеренні проміжки з утворенням фосфіду заліза
. Але при твердненні сталі розчинюваність істотно зменшується, що спричинює дифузію фосфору із зерна в міжзеренні проміжки з утворенням фосфіду заліза 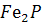 Таке явище називають ліквацією фосфору, що призводить до мікронеоднорідності сталі.
Таке явище називають ліквацією фосфору, що призводить до мікронеоднорідності сталі.
Із підвищенням концентрації фосфору сталь стає хладноламкою. Це явище полягав в підвищенні крихкості, зниженні пластичності та ударної в’язкості сталі при низьких (мінусових) температурах. Фосфор знижує зварюваність сталі, сприяючи утворенню тріщин у шві електрозварювання.
Через таку дію фосфор належить до шкідливих домішок у сталі, які потрібно видаляти. Але іноді його використовують як легуючий елемент, коли, наприклад, потрібно зменшити пластичність сталі при її різанні або при пічному зварюванні.
Сірка створює в сталі розчини заміщення та вкорінення і з'єднується із залізом у сполуки типу 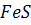 . Сульфіди заліза мають низьку температуру плавлення –
. Сульфіди заліза мають низьку температуру плавлення – 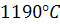 . Тому в процесі гарячої обробки сталі тиском, що відбувається при температурах, близьких до зазначеної, сульфіди заліза втрачають міцність. Оскільки сірка при затвердненні сталі ліквує на межі зерен, при механічному тиску саме тут порушується цілісність металу, що проявляється в утворенні тріщин. Це явище називають червоноламкістю і в прокатному виробництві насамперед воно в причиною браку сталі.
. Тому в процесі гарячої обробки сталі тиском, що відбувається при температурах, близьких до зазначеної, сульфіди заліза втрачають міцність. Оскільки сірка при затвердненні сталі ліквує на межі зерен, при механічному тиску саме тут порушується цілісність металу, що проявляється в утворенні тріщин. Це явище називають червоноламкістю і в прокатному виробництві насамперед воно в причиною браку сталі.
Запобігти червоноламкості можна введенням у сталь елементів, то створюють із сіркою сульфіди ще тоді, коли сталь перебував в рідкому стані. Це можливо, якщо температура плавлення сульфідів перевищує температуру рідкої сталі, яка звичайно дорівнює 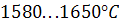 . Ці сульфіди мають мікроскопічний розмір і перебувають у рідкій сталі в твердому стані. Під час тверднення сталі вони залишаються в межах зерна, а внаслідок того, що вміст розчиненої сірки став меншим за межу розчинності в твердому залізі, її ліквації на межі зерен не відбувається. Тому в процесі гарячої обробки сталі межі зерен, що не мають сульфідів низької міцності, витримують механічні напруження, і тріщин не утворюється.
. Ці сульфіди мають мікроскопічний розмір і перебувають у рідкій сталі в твердому стані. Під час тверднення сталі вони залишаються в межах зерна, а внаслідок того, що вміст розчиненої сірки став меншим за межу розчинності в твердому залізі, її ліквації на межі зерен не відбувається. Тому в процесі гарячої обробки сталі межі зерен, що не мають сульфідів низької міцності, витримують механічні напруження, і тріщин не утворюється.
До елементів, що сприяють усуненню червоноламкості,належать марганець, алюміній і особливо рідкісноземельні елементи, з яких найпоширеніші лантан і церій.
Вміст сірки в більшості сталей в небажаним, і тому потребує
її усунення. Дише іноді, коли необхідно підвищити крихкість сталі та поліпшити її оброблюваність різанням, сірка додатково вводиться в сталь, яку називають автоматною.
Кисень утворює в залізі розчини вкорінення й існує в них як катіон 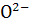 , який, поєднуючись із
, який, поєднуючись із 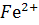 , створює сполуки типу
, створює сполуки типу 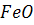 .
.
У рідкому залізі розчинюваність кисню обмежена – 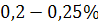 , а в твердому зменшується до
, а в твердому зменшується до 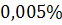 . Тому під час тверднення сталі кисень дифундує з металу зерна на його межі, утворюючи Fе О , а остання дає з FeS евтектики з температурою плавлення, нижчою за
. Тому під час тверднення сталі кисень дифундує з металу зерна на його межі, утворюючи Fе О , а остання дає з FeS евтектики з температурою плавлення, нижчою за 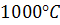 . Тому підвищений вміст у стаді не лише сірки, а й кисню, істотно підвищує червоноламкість сталі. Для запобігання цьому явищу використовують розкислення сталі, яке здійснюється шляхом уведення в сталь елементів, що мають спорідненість із киснем більшу, ніж у заліза. Найчастіше для розкислення застосовують марганець, кремній, алюміній та ін. Оксиди, які утворюються при цьому, часто мають температуру плавлення, що перевищує фактичну температуру рідкої сталі. Тому коли ці елементи потрапляють у рідку сталь, кисень переходить Із розчиненого стану в зв’язаний в оксиди в твердому стані. Якщо вміст кисню, що залишився в розчині, менший, ніж вміст розчинюваності в твердому залізі, то під час тверднення сталі ліквації кисню з металу зерен до міжзеренних меж не відбувається і червоноламкість усувається.
. Тому підвищений вміст у стаді не лише сірки, а й кисню, істотно підвищує червоноламкість сталі. Для запобігання цьому явищу використовують розкислення сталі, яке здійснюється шляхом уведення в сталь елементів, що мають спорідненість із киснем більшу, ніж у заліза. Найчастіше для розкислення застосовують марганець, кремній, алюміній та ін. Оксиди, які утворюються при цьому, часто мають температуру плавлення, що перевищує фактичну температуру рідкої сталі. Тому коли ці елементи потрапляють у рідку сталь, кисень переходить Із розчиненого стану в зв’язаний в оксиди в твердому стані. Якщо вміст кисню, що залишився в розчині, менший, ніж вміст розчинюваності в твердому залізі, то під час тверднення сталі ліквації кисню з металу зерен до міжзеренних меж не відбувається і червоноламкість усувається.
Азот створює в залізі розчини вкорінення у вигляді атомарного азоту. Концентрація розчинюваності в залізі обмежується 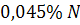 при температурі
при температурі 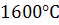 . Водночас у твердому залізі розчинюваність азоту становить лише
. Водночас у твердому залізі розчинюваність азоту становить лише 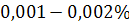 . Тому під час тверднення сталі відбувається перенасичення заліза азотом. У такому стані сталь залишається тривалий час, що обчислюється роками. Поступово азот з’єднується із залізом у сполуки типу
. Тому під час тверднення сталі відбувається перенасичення заліза азотом. У такому стані сталь залишається тривалий час, що обчислюється роками. Поступово азот з’єднується із залізом у сполуки типу 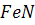 , що спричинює зниження механічних властивостей сталі. Це явище називають старінням сталі. Воно дуже небезпечне, бо якщо вироблена сталь з підвищеним вмістом азоту має спочатку потрібні властивості згідно із стандартом, то під час роботи виготовленого з неї об’єкт у останній поступово втрачатиме необхідні властивості, що призведе до його руйнування в непередбачуваний момент.
, що спричинює зниження механічних властивостей сталі. Це явище називають старінням сталі. Воно дуже небезпечне, бо якщо вироблена сталь з підвищеним вмістом азоту має спочатку потрібні властивості згідно із стандартом, то під час роботи виготовленого з неї об’єкт у останній поступово втрачатиме необхідні властивості, що призведе до його руйнування в непередбачуваний момент.
Чим відповідальнішим є об’єкт, тим важливіше запобігти старінню сталі, яку використовують для його виготовлення. Це досягається шляхом уведення в сталь елементів, що створюють з азотом сполуки – нітриди ще в рідкому стані сталі. До таких елементів деякою мірою належать кремній і алюміній, але радикально розв'язують проблему ванадій, титан і цирконій. Завдяки тому, що азот із розчину в залізі переходить у нітриди, його вміст у розчині знижується і під час подальшої роботи твердої сталі старіння не відбувається. Такі сталі називають нестаріючими. Оскільки для виготовлення такої сталі потрібні феросплави, що містять ці дорогі елементи, нестаріючі сталі виготовляють лише у відповідальних випадках.
Азот підвищує зносостійкість твердої сталі і за потреби сталь може бути легована азотом до 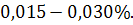
Водень створює в залізі розчини вкорінення і перебуває в них у вигляді атомів або протонів. Розчинність водню в рідкому залізі досягає 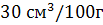 сталі, а в твердому знижується до
сталі, а в твердому знижується до 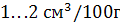 . Розчинність водню в твердій сталі різко знижується в межах температур
. Розчинність водню в твердій сталі різко знижується в межах температур 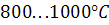 , що звичайно відповідає завершенню гарячої обробки металу тиском. Завдяки малому розміру атому водню, а тим більше протону, його дифузія відбувається з великою швидкістю. Тому водень у гарячому стані сталі швидко дифундує до місць із дефектами будови, накопичується в них, спричинюючи місцеві напруження виділення порядку
, що звичайно відповідає завершенню гарячої обробки металу тиском. Завдяки малому розміру атому водню, а тим більше протону, його дифузія відбувається з великою швидкістю. Тому водень у гарячому стані сталі швидко дифундує до місць із дефектами будови, накопичується в них, спричинюючи місцеві напруження виділення порядку 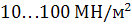 , що можуть перевищувати межу міцності сталі й призвести до порушення її цілісності шляхом утворення тріщин. Мікроскопічні за товщиною тріщини називають флокенами, які спричинюють руйнування сталі своєрідного типу, що називають шиферним зламом. До сталей, що насамперед схильні до утворення флокенів, тобто флокеночутливих, належать сталі з високим вмістом вуглецю і легуючих елементів.
, що можуть перевищувати межу міцності сталі й призвести до порушення її цілісності шляхом утворення тріщин. Мікроскопічні за товщиною тріщини називають флокенами, які спричинюють руйнування сталі своєрідного типу, що називають шиферним зламом. До сталей, що насамперед схильні до утворення флокенів, тобто флокеночутливих, належать сталі з високим вмістом вуглецю і легуючих елементів.
Запобігти утворенню флокенів можна, знижуючи вміст водню в рідкій сталі до критичних меж, що дорівнюють його розчинності в твердій сталі. Це здійснюється переважно шляхом вакуумування сталі.
У більшості випадків елементи кольорових металів, що потрапляють у сталь унаслідок забруднення ними металевого брухту, є шкідливими домішками. Наприклад, мідь спричинює червоноламкість сталі через низьку температуру плавлення, а олово посилює цей недолік унаслідок подальшого зниження останньої. При виробництві сталі відповідального призначення вміст кольорових металів має бути обмеженим, що призвело до необхідності розробки технологій їх видалення з виготовленої сталі.
У металевій шихті, чавуні та брухті, з яких виготовляють сталь, містяться неметалеві включення різних типів. Під час виготовлення сталі до них додаються неметалеві включення, що утворюються внаслідок окислення елементів, розкислення та легування сталі тощо. Ці включення, що мають ендогенне походження, бувають різних типів: оксиди 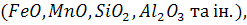 сульфіди
сульфіди 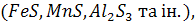 оксисульфіди, тобто сполуки оксидів і сульфідів, нітриди
оксисульфіди, тобто сполуки оксидів і сульфідів, нітриди 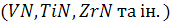 , карбіди
, карбіди 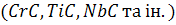 .
.
У більшості випадків ендогенні неметалеві включення впливають властивості сталі негативно. Але іноді, як зазначалося, потрібно утворювати неметалеві включення шляхом виведення елементів із розчину, оскільки це запобігає шкідливим наслідкам наявності цих елементів у розчині (кисень, сірка, азот та ін.). Проте в деяких випадних утворення таких неметалевих включень, як нітриди і карбіди, навпаки, надає сталі потрібних властивостей.
Неметалеві включення видаляються під час позаагрегатної обробки сталі, але певна їх кількість залишається і в твердій сталі. Тому сталь великої відповідальності перевіряють на вміст неметалевих включень мікроскопічним обстеженням.
До рідкої сталі ззовні потрапляють екзогенні неметалеві включення, що в переважній більшості випадків є оксидами з футеровки, шлаку та різних неметалевих матеріалів. Іноді ці включення мають такий розмір, що їх можна побачити неозброєним оком. Це відбувається під час контролю поверхні готового прокату і може бути приводом для переведення забрудненої ними сталі у брак.
Рідка сталь має певні фізичні властивості.
Густина рідкої сталі становить приблизно 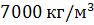 , а твердої -
, а твердої - 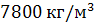 . Тому при твердненні сталі її питомий об"єм зменшується, що спричинює утворення усадочної раковини.
. Тому при твердненні сталі її питомий об"єм зменшується, що спричинює утворення усадочної раковини.
Температура плавлення заліза дорівнює 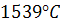 і зменшується при розчиненні в залізі елементів, особливо вуглецю. Тому іноді температуру плавлення сталі в градусах Цельсія обчислюють за емпіричними рівняннями типу:
і зменшується при розчиненні в залізі елементів, особливо вуглецю. Тому іноді температуру плавлення сталі в градусах Цельсія обчислюють за емпіричними рівняннями типу:
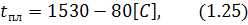
де вміст вуглецю обчислюють в процентах.
Знаючи температуру плавлення, можна розрахувати кінцеву температуру виплавки сталі, додаючи до першої потрібне перегрівання 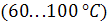 , що забезпечує розливку усієї сталі протягом необхідного часу без залишків затверділого під час розливки металу.
, що забезпечує розливку усієї сталі протягом необхідного часу без залишків затверділого під час розливки металу.
Дата добавления: 2020-02-05; просмотров: 633;











