Хімічна термодинаміка
Хімічна термодинаміка вивчає питання фазової рівноваги при розподілі компонентів між фазами.
У металургії сталі фазами є метал; шлак; тверді шихтові матеріали, що розчиняються в металі та шлаці; футеровка агрегату; газова атмосфера над сталеплавильною ванною або газ, що тимчасово перебуває в рідких фазах.
Якщо компонент розчиняється в контактуючих фазах, він розподіляється між ними згідно зі своїми термодинамічними властивостями в фазах.
Наприклад, марганець як елемент, що розчиняється в металі, може переходити до шлакової фази, в якій він перебуває як оксид марганцю, згідно з рівнянням:
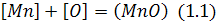
або:
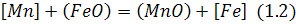
Якщо компонент розчиняється в металі, його символ наводять в квадратних дужках [ ] , якщо в шлаці – ( ) , у газовій атмосфері – { }, у твердому стані – < >.
Кожне рівняння має свою константу рівноваги, яку позначають літерою «К», іноді з позначками, до якого саме рівняння ця константа належить. Наприклад, для рівняння (1.1) це 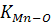 , а для рівняння (1.2)
, а для рівняння (1.2) 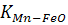 .
.
Константу рівняння записують як дріб, у чисельнику якого міститься добуток активностей компонентів, які утворюються внаслідок реакції, в степенях, що відповідають стехіометричним коефіцієнтам рівняння при відповідних компонентах, а в знаменнику – добуток активностей компонентів, що вступають у реакцію, у відповідних степенях.
Наприклад, для рівняння (1.2):
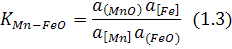
Найчастіше, якщо припустимо, дужки в символах компонентів не вживають. Якщо вміст компонента у фазі наближається до 1ОО% або якщо фаза ним насичена, активність компонента прирівнюється до одиниці і до запису константи не входить. У рівнянні (1.3) цій вимозі найчастіше відповідає 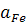
Іноді використовують показник розподілу компонента між фазами, який записують через концентрації, а не через активності. Для рівняння (1.3), наприклад,
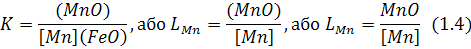
На відміну від константи рівноваги (1.3), що залежить лиш від температури, при якій відбувається хімічна реакція, показники (1.4) змінюються як у разі зміни температури, так і в разі зміни хімічного складу реагуючих фаз, тобто не можуть вважатися константами - сталими величинами.
Температурна залежність константи рівноваги, наприклад, для добре вивченого рівняння (1.2) мав вигляд:
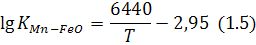
Якщо в (1.5) підставити температуру» при якій відбувається реакція (1.2), у градусах Кельвіна, то в результаті розрахунків здобудемо величину правої частини тотожності (1.3). А це дає змогу при відомих, наприклад, складі шлаку й активностях оксидів марганцю та заліза в ньому розрахувати рівноважний із ними вміст марганцю в металі. За допомогою таких розрахунків, порівнявши рівноважний та фактичний вмісти марганцю, можна передбачити, в якому напрямі відбуватиметься реакція (1.2): якщо фактичний вміст перевищує рівноважний – вправо,якщо менший від нього – вліво. Іноді розрахувати активності компонентів у фазах дуже важко, особливо для шлакової фази, або футеровки.
Для газової фази доведено, що парціальний тиск компонента дорівнює його концентрації.
Для металу протягом останніх десятиріч експериментально визначаються та уточнюються способи розрахунку активностей розчинених у
цьому елементів.
У загальному вигляді активність компонента розведеного розчину,який є метал, у розчині з компонентами: i, j, k, l і т.д.:
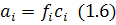
де: 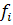 – коефіцієнт активності компонента;
– коефіцієнт активності компонента; 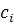 – концентрація компонента
– концентрація компонента
У свою чергу:
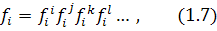
де: 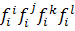 – коефіцієнти активності компонента відповідно до їх взаємодії з компонентами i,j,k,l,...
– коефіцієнти активності компонента відповідно до їх взаємодії з компонентами i,j,k,l,...
Взаємодію, наприклад, компонентів і та j розраховують так:
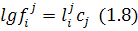
де 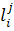 – параметр взаємодії
– параметр взаємодії 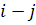 ;
; 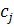 – концентрація компонента j , %.
– концентрація компонента j , %.
Нині майже для всіх елементів сталі визначено параметри взаємодії l. У різних дослідженнях вони мають різні значення, які розбігаються іноді на порядок. Проте їх можна вважати більш-менш визначеними.
У результаті спільного розв’язання рівнянь (1.7)(1.8) дістаємо рівняння для розрахунку коефіцієнта активності компонента 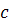 :
:
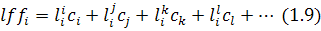
Якщо концентрація елемента наводиться в мольних частках 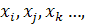 то рівняння для коефіцієнта активності
то рівняння для коефіцієнта активності 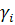 ; має вигляд:
; має вигляд:
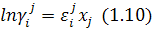
де: 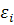 – параметр взаємодії. При цьому активність компонента
– параметр взаємодії. При цьому активність компонента 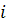 :
:
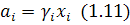
Величина 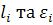 різняться на один-два порядки і в довідниках наводяться в обох виглядах, що потрібно враховувати при їх визначенні.
різняться на один-два порядки і в довідниках наводяться в обох виглядах, що потрібно враховувати при їх визначенні.
Розрахунковий спосіб визначення активностей компонентів металу досить простий завдяки тому, що метал найчастіше є розведеним розчином, тобто вмісти в ньому розчинника та розчиненої речовини різняться щонайменше на порядок. На жаль, це стосується лише окремих компонентів сталеплавильних шлаків, що й створює утруднення при обчисленні активностей останніх. Існуючі способи розрахунку активностей шлаків наводяться далі.
Хімічна кінетика
Якщо система контактуючих фаз перебував в не рівноважному стані, то можлива хімічна реакція, швидкість протікання та етапи якої вивчав хімічна кінетика.
Якщо хімічна реакція відбувається в гомогенному середовищі, йдеться про гомогенну хімічну реакцію. Гетерогенні хімічні реакції відбуваються на межі між не змішуваними фазами.
Згідно із законом діючих мас:
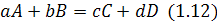
швидкість хімічної реакції взаємодіючих компонентів 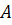 та
та 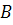 :
:
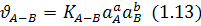
де: 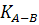 – константа швидкості хімічної реакції,
– константа швидкості хімічної реакції,
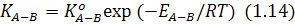
де: 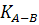 – коефіцієнт;
– коефіцієнт; 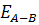 – енергія активації хімічної реакції;
– енергія активації хімічної реакції; 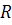 – універсальна газова стала;
– універсальна газова стала; 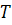 – температура, при якій відбувається реакція, К.
– температура, при якій відбувається реакція, К.
Із підвищенням 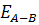 , швидкість хімічної реакції при даній температурі
, швидкість хімічної реакції при даній температурі 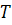 знижується, але залежність її від останньої вростав і вона збільшується з підвищенням температури швидше.
знижується, але залежність її від останньої вростав і вона збільшується з підвищенням температури швидше.
У рівнянні (1.13) суму показників степенів 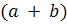 називають порядком хімічної реакції, у той час як суму кількості реагуючих молекул (у рівнянні (1. 1З)) також
називають порядком хімічної реакції, у той час як суму кількості реагуючих молекул (у рівнянні (1. 1З)) також 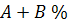 називається молекулярністю реакції. Випадок, коли порядок реакції дорівнює молекулярності, як у рівнянні (1.13), є ідеальним. Найчастіше порядок реакції відрізняється від молекулярності і може бути будь-яким числом, що дорівнює нулю або перевищує його. Це є наслідком того, що найчастіше хімічна реакція відбувається в кілька етапів.
називається молекулярністю реакції. Випадок, коли порядок реакції дорівнює молекулярності, як у рівнянні (1.13), є ідеальним. Найчастіше порядок реакції відрізняється від молекулярності і може бути будь-яким числом, що дорівнює нулю або перевищує його. Це є наслідком того, що найчастіше хімічна реакція відбувається в кілька етапів.
Наприклад, одна з найважливіших хімічних реакцій сталеплавильного виробництва окислювання вуглецю киснем газової фази
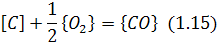
відбувається в такій послідовності.
У газовій фазі молекула кисню 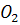 може дисоціювати з утворенням атомарного кисню, більш реакційноздатного, ніж молекулярний кисень:
може дисоціювати з утворенням атомарного кисню, більш реакційноздатного, ніж молекулярний кисень:
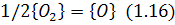
Атомарний кисень адсорбується на поверхні металу
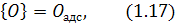
де вступає у взаємодію з атомом вуглецю:
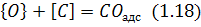
з утворенням монооксиду вуглецю,який від адсорбованого стану переходить у газову фазу:
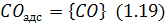
Отже, реакції (1.16–1.19) є послідовними етапами сумарної реакції (1.15). Серед цих етапів найповільнішими в етапи (1.16) і (1.17), енергія активації яких найбільша. Іноді їх об’єднують в один етап, який називають актом хемадсорбції, вважаючи, що метал відіграв роль каталізатора для реакції (1.16).
Якщо реакція складна і складається з кількох етапів, як у розглядуваному випадку реакція (1.15), швидкість сумарної реакції можна розрахувати за правилом адитивності:
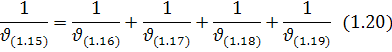
де 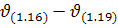 – швидкість реакції відповідно (1.16-1.19).
– швидкість реакції відповідно (1.16-1.19).
Оскільки етапи (1.16), (1.17) найповільніші, а їх загальна швидкість 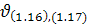 найменша, то
найменша, то 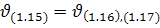 .
.
З іншого боку, якщо знову розглянути загальну форму рівняння (1.1З), то для реакції (1.15) вона повинна мати такий вигляд:
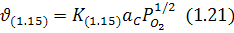
Але якщо насправді швидкість реакції (1.15) визначається швидкістю реакцій (1.16), (1.17), то фактично:
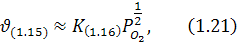
або
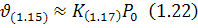
Якщо загальна швидкість реакції визначається швидкістю окремого етапу, порядок реакції відрізняється від молекулярності загальної реакції (1.15) і дорівнює молекулярності лімітуючого етапу (1.16) або (1.17). Тому реакцію (1.15) називають формальною, оскільки насправді швидкість процесу окислення вуглецю киснем газової фази визначається швидкістю дисоціації молекулярного кисню на атоми.
Кожний фізико-хімічний процес складається з власне хімічної реакції та процесів масо переносу, завдяки яким реагуючі компоненти підводяться до поверхні, до відбувається хімічна реакція, а продукти реакції, що створюються, відводяться від неї. Розроблюючи технологію процесу, необхідно знати, які саме ланки його масо перенос або хімічна реакція – є лімітуючими, бо вплив на їх прискорення чи, навпаки, сповільнення різний.
Лімітуючі ланки процесу вивчає дифузійна кінетика.
Існують ознаки, за якими визначається лімітуюча ланка процесу на стадії хімічної реакції чи масопереносу, а саме:
- якщо фактична залежність швидкості процесу від концентрації реагуючих речовин має порядок, відмінний від одиниці, то процес визначається хімічною реакцією, бо процеси масопереному відбуваються зі швидкістю, прямо пропорційною до концентрації;
- якщо перемішування однієї з реагуючих фаз, яке відбувається без зміни площі поверхні реакції, впливає на швидкість процесу, то масоперенос саме в цій фазі визначає швидкість процесу в цілому;
- чим істотніше температура впливає на швидкість процесу, тим імовірніше, що саме хімічна реакція визначає швидкість загального процесу.
Тривалий час, ураховуючи досвід з дифузійної кінетики, набутий при вивченні процесів, які відбуваються при звичайних температурах, вважалося, що при високих температурах сталеплавильних процесів хімічна реакція не може бути лімітуючою, оскільки температура істотно впливає на швидкість хімічної реакції. Але поступово, дістаючи фактичні відомості щодо енергії активації процесу, доходимо висновку, що необхідно розглядати кожний процес у конкретних обставинах. Через істотні швидкості реагуючих фаз можливі випадки, коли процеси масопереносу випереджають хімічні перетворення і саме останні стають лімітуючими.
Нині набутих знань щодо швидкості окремих хімічних реакцій сталеплавильних процесів надто мало, і вони потребують вдосконалення. Тому швидкості сталеплавильних процесів у деяких випадках розраховують лише приблизно.
Дата добавления: 2020-02-05; просмотров: 864;











