Метод ионного обмена и его применение при обработке воды
Реагентные методы умягчения воды имеют ряд существенных недостатков:
1. Не дают достаточной степени умягчения.
2. Требуют значительного расхода продуктов.
3. Сложны по техническому осуществлению.
В настоящее время в практике водоподготовки стал широко применяться ионообменный метод умягчения воды.
Достоинства:
1. Не образуется осадка.
2. Не нужно дозирование реагента.
3. Достигается значительная степень умягчения воды.
4. Уменьшается солесодержание воды.
Природные, искусственные и синтетические материалы, способные к обмену входящих в их состав ионов на ионы контактирующего с ними раствора, называют ионитами.
Иониты, содержащие подвижные катионы, называют катионитами, а обменивающие анионы – анионитами.
Наиболее практическое значение имеют органические полимерные иониты, которые являются полиэлектролитами. В этих соединениях одни ионы (катионы или анионы) фиксированы на углеводородной основе (матрице). А ионы противоположного знака являются подвижными, способными к обмену на одинаковые по знаку заряда ионы, содержащиеся в растворе.
Катионы по химической природе – полимерные кислоты или их соли. На участках матрицы у них расположены полярные группы, содержащие подвижные катионы водорода, натрия и др. (Н+, Na+).
Катионы, содержащие в качестве активной группы сульфогруппу SO3H, являются сильнокислотными.
Звено сульфокатионита КУ -2 имеет строение:
-CH - CH2 – CH2 – CH - CH2 - CH
| | |



| | |
SO3H
-CH - CH2 – CH2 - CH – CH2 - CH –
|

|
SO3H
Иониты не растворимы в воде, так как их матрица гидрофобна.
Активные полярные группы гидрофильны. Активная группа в воде диссоциирует с образованием фиксированного на матрице аниона и подвижного катиона, который оказывается в растворе в непосредственной близости от активной группы.
Если условно обозначить фиксированный на матрице анион сульфокатионита через RSO3-, то процесс диссоциации протекает по схеме
R-SO3H↔ RSO3- + H+
Катионы, содержащие карбоксильные группы – СООН, характерные для карбоновых кислот, относятся к слабокислотным. Они способны к обмену ионов в щелочной среде, например, КБ -4.
Катионы, содержащие различные активные группы занимают промежуточное положение между слабо – и - сильнокислотными. К ним относятся:
1. Сульфоугли, содержащие группы – SO3H4 – COOH
2. Катионит КУ -1, содержащий SO3H и ОН.
Рабочей формой катионита будет кислотная (Н – катионит) и солевая (Na – катионит).
Аниониты – являются полимерными основаниями или их солями. Матрица анионита содержит активные полярные группы, способные диссоциировать в воде с образованием подвижных анионов (ОН-, Cl- и др).
Анионит на основе пиридина имеет строение:
СН2 -CH - CH2 – CH – CH2 - CH -
| | |



| | |
N+
|
Сl-
-CH2 - CH – CH2 - CH – CH2 - CH –
|

|
N+
|
Сl-
Диссоциация идет по схеме R+Cl- ↔R+ + Cl-, где
R+ - фиксированный на матрице катион, условно принятый за однозарядный.
Способность ионитов к обмену ионов количественно характеризуется обменной емкостью, то есть числом миллиграмм – эквивалентов ионов, обменивающихся определенной навеской сухого или определенным объемом набухшего ионита.
В зависимости от условий различают: полную (ПОС), статическую (СОЕ) и динамическую (рабочую) обменную емкость (ДОЕ, РОЕ) ионита.
Полная обменная емкость характеризуется общим числом активных групп ионита в единице объема смолы.
Статическая обменная емкость определяется числом мг –экв. ионов обменивающихся при контакте раствора с определенным количеством ионита (1г в расчете на абсолютно сухой продукт).
Рабочая (динамическая) обменная емкость определяется количеством ионов (мг-экв/дм3), поглощенных определенным объемом набухшего ионита в процессе фильтрования до момента появления этих ионов в фильтрате.
Она зависит:
1. От природы ионита.
2. От природы поглощаемых ионов.
3. Солесодержания.
4. Величины рН.
5. Скорости фильтрования.
6. Высоты слоя ионита.
7. Фракционного состава.
8. Режима работы фильтра.
Отработанные иониты можно регенерировать. Регенерация катионитов проводится растворами кислот (для Н – катионитов) или солей.
Аниониты регенерируют растворами гидроксида, хлорида или карбоната натрия, соляной кислоты.
Обработка воды на катионитах называется катионированием, а на анионитах анионированием.
Основные марки синтетических ионитов, применяющихся при обработке воды.
1. Катионит универсальный КУ -2 – это сульфированный сополимер стирола с 8% дивинилбензола. Сильнокислый катионит. Выпускается в виде гранул. Нерастворим в органических растворителях. Выдерживает нагревание до 120 0С, устйчив к действию кислот, щелочей и некоторых окислителей. ПОЕ по 0,1 н. раствору NaOH составляет 4,9 мг-экв/г. Применяется для умягчения и обессоливания воды и для очистки ПСВ от катионов тяжелых металлов.
2. Катионит карбоксильный КБ -4П-2 получают сополимеризацией метилметакрилата с дивинилбензолом. Гранулы белого и светлого цвета. Используют для тонкой очистки воды.
3. Анионит высокоосновной АВ -17 ПОЕ по 0,1 раствору HCl ≈ 3,5 мг-эвк/г.
Применяется при обессоливании воды для удаления кремниевой кислоты и для очистки СВ, содержащих тяжелые металлы в виде анионов.
4. Анионит низкоосновной АН -22 ПОЕ -5 мг-экв/г.
Кроме этих ионитов используется сульфоуголь (катионит) – продукт обработки бурого угля серной кислотой. ПОЕ – 1,8-1,9 мг-экв/г.
Низкая ОЕ и невысокая химическая и термическая устойчивость ограничивает применение сульфоугля.
Na – катионирование
2NaR + CaCl2↔ CaR2 +2NaCl
2NaR + MgSO4 ↔ MgR2+Na2SO4
Na – катионитовые фильтры регенерируют 5-10-% - ным раствором хлорида натрия.
CaR2 + 2NaCl↔ 2RNa +CaCl2
MgR2 + 2NaCl↔ 2RNa +MgCl2
Умягченная вода имеет повышенную щелочность. Ее дополнительно обрабатывают кислотами.
Н- катионирование
Са(НСО3)2 + 2НR↔ CaR2+2[Н2О +СО2]
Mg(НСО3)2 + 2НR↔ MgR2+2[Н2О +СО2] и т.д.
Н – катионирование применимо для вод с небольшой (до 1 мг-экв/л) некарбонатной жесткостью.
Умягченная вода не содержит карбонатов, которые заменяются свободной углекислотой.
Вода после Н – катионирования имеет кислую реакцию среды и является агрессивной по отношению к металлам. (Можно нейтрализовать фильтрат NaOH).
Для получения стабильной воды применяют Н – и Na - катиониты с последующим смешением воды.
Н – катиониты рнегенерируют 5% - ным раствором соляной кислоты или 1 -1,5% раствором серной кислоты.
CaR2 + 2НCl↔ 2НR +CaCl2
MgR2 + Н2SO4↔ 2HR +MgSO4
Обессоливание воды
Метод обработки воды, направленный на снижение общего солесодержания, называется обессоливанием.
Полной обессоливание – остаточное солесодержание 0,01, 0,1мг/л.
Частичное обессоливание - удаление отдельных ионов.
Опреснение – один из случаев обессоливания.
8.1.4.1. Метод ионного обмена.
Сущность метода заключается в последовательном пропускании воды через Н – катионитовый и ОН- - анионитовый фильтры.
RH +NaCl↔ NaR + HCl
2RH + Na2SO4 ↔ 2RNa + H2SO4
RH + NaHCO3 ↔ NaR +[CO2 +H2O]
При этом образуются свободная углекислота и эквивалентное количество НСl и H2SO4. Затем фильтруют через анионит.
ROH + HCl ↔ RCl + H2O
2ROH + H2SO4 ↔ R2SO4 + H2O
Рассмотрим схему полного химического обессоливания:
1 – катионитовый фильтр I ступени (сульфоуголь, КУ-2),
2 - анионитовый фильтр I ступени,
3 - катионитовый фильтр II ступени,
4 - декарбонизатор,
5 – резервный бак,
6 – анионитовый фильтр II ступени,
7 - катионитовый фильтр III ступени,
8 – анионитовый фильтр III ступени.
I ступень идет на Н – каионитовых и ОН – анионитовых фильтрах.
На катионите (сульфоуголь, КУ -2) происходит обмен основных катионов на ионы Н+. И переход гидрокарбоната в свободную угольную кислоту (регенерация серной или азотной кислотой).
На анионите (ЭДЭ -10П) анионы сильных кислот (SO42-, Cl-) на ОН-, анионы слабых кислот остаются в растворе, регенерация раствором NaOH.
II ступень обессоливания предназначается для обмена катионов и анионов, оставшихся после обработки воды на фильтрах I ступени. Перед подачей на анионит II ступени производится удаление свободной углекислоты физическими методами. На анионите II ступени идет обескремнивание воды и удаление оставшихся анионов угольной кислоты. Регенерация NaOH.
III ступень глубокого обессоливания служит для удаления ионов попавших с ионитов I и II ступени. Это буферные фильтры.
Химически обессоленная вода содержит небольшое количество органики. Часть их способна диссоциировать и вступает в реакции обмена с ионитами. Недиссоциирующая органика частично адсорбируется на поверхности зерен ионита. Если окисляемость исходной воды составляет более 15 -20 мг О 2/л, перед Н – каионитом ставят фильтр с активированным или другими адсорбентами. Полностью обессоленная вода (сверхчистая) имеет неустойчивое значение рН, так как в ней отсутствует буферная система. При концентрации СО2 1 мг/л вода имеет рН 5,5 -5,6. В такой воде растворяются труднорастворимые соединения: Fe(OH)3, CaCO3, Al(OH)3. К действию такой воды устойчивы: титан, луженые медь, латунь, полиэтилен, тефлон, полипропилен.
8.1.4.2. Метод электродиализа
Электродиализ – это процесс переноса ионов под действием постоянного электрического тока к электродам через полупроницаемую мембрану, помещенную в раствор электролита.
Электродиализатор состоит из трех камер: катодной, анодной и средней рабочей. Средняя отделена перегородками - мембранами.
Мембраны не пропускают коллоиды, но пропускают воду и ионы электролита.
В средней камере вода подлежащая обессоливанию. В катодную камеру поступают катионы: Na+, Ca2+, H+, Mg2+ и др.
Ионы водорода восстанавливаются на катоде до свободного состояния:
2Н+ + 2ē → Н2
В анодную камеру поступают анионы (Сl-, HCO3-, SO42- и др.) и гидроксид – иона.
4ОН- - 4ē →2Н2О + О2
2Cl- - 2ē → Cl2↑
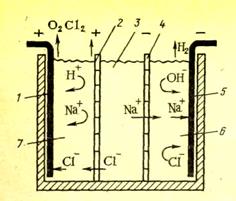
|
Производительность можно увеличить использованием ионитовых мембран.
Рис. 3. Схема трехкамерной ячейки электродиализатора:
1 – анод; 2 – анионитовая мембрана; 3- камера обессоливания; 4- катионитовая мембрана; 5 – катод; 6 – катодная камера; 7 – анодная камера.
Использование трехкамерного диализатора нерентабельно. Чаще применяются многокамерные диализаторы. При этом количество энергии снижается с 60-70 до 1-2%.
Электродиализных установки применяются для обессоливания морских и минерализованных вод, а также в оборотных системах водоснабжения. Электродиализ используют при минерализации воды от 3,5 до 35 г/кг, и при остаточном солесодержания не менее 400 мг/л. Содержание взвешенных веществ не более 3 мг/л;
железа – 0,1 мг/л;
бора – 0,1 мг/л;
цветность – не выше 200С, окисляемость до 5 мг О2/л.
8.1.4.3. Гиперфильтрация (обратный осмос)
Основан на использовании осмотического переноса молекул воды через полупроницаемую мембрану. Такая мембрана проницаема для молекул воды, но не пропускает молекулы и ионы растворенных в воде веществ. Явление осмоса состоит в том, что при неодинаковых концентрациях раствора с разных сторон полупроницаемой мембраны молекулы воды будут диффундировать через нее из раствора с меньшей концентрацией в раствор с большей концентрацией. Величина возникающего осмотического давления зависит от разности концентраций растворов по обе стороны мембраны: чем она больше, тем выше осмотическое давление. При разности концентраций растворов, соответствующих солесодержанию морской воды (35 г/кг) и дистиллированной (10мг/л), осмотическое давление составляет 24∙102 кПа. Обратный процесс – диффузию молекул воды через мембрану в раствор с меньшей концентрацией можно осуществить, подавая концентрированный раствор на мембрану под давлением, превышающим осмотическое.
Перенос молекул воды через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией под действием внешнего давления, превышающего осмотическое давление, называется обратным осмосом или гиперфильтрацией.
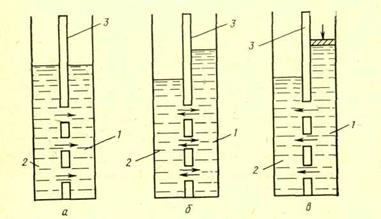
|
Рис. 4. Схема движения молекул воды через полупроницаемую мембрану:
а – состояние равновесия; б – осмотический перенос; в – обратный осмос;
1- соленая вода; 2- пресная вода; 3- мембрана.
Определяющими характеристиками полупроницаемых мембран являются селективность, проницаемость по воде, стабильность показателей во времени. Селективность мембран S характеризует степень задержания растворенных компонентов и рассчитывается по формуле
S= (Сисх – Сост) ∙100/Сисх ,
где Сисх - концентрация растворенных солей в опресняемой воде;
Сост - остаточная концентрация солей в опресненной воде.
Селективность мембран зависит от солесодержания исходной воды. В интервале концентраций раствора от 0,5 до 10 г/л селективность изменяется незначительно.
8.1.4.4. Газгидратный метод опреснения воды основан на том, что при определенной температуре и давлении некоторые газы образуют с водой кристаллогидраты, выпадающие в виде твердой фазы. Соединения, образующиеся в результате внедрения молекул газа в полости кристаллической решетки льда, называются газгидратами. При этом происходит внедрение молекул газа в полости кристаллической решетки льда, химическое взаимодействие при этом не происходит.
Формула газгидратов:
М∙nН2О, где
М- вещество (газ).
Газгидраты могут иметь структуры I и II. Элементарная ячейка структуры I содержит 46 молекул воды и 8 полостей.
8М∙46 Н2О
Элементарная ячейка структуры II содержит 136 молекул воды, 8 больших и 16 малых полостей.
8М∙136 Н2О
Газгидраты образуются только в малых полостях. Наилучшими гидратообразующими веществами являются:
-пропан C3H8,
-фреоны СF2Cl2.
Температура зависит от солесодержания, при этом температура увеличивается и систему необходимо охлаждать, на поверхности образуется слой рассола, необходима промывка.
8.1.4.5. Дистилляционный метод
При нагревании опресняемой воды до температуры кипения происходит интенсивное образование пара, который почти не содержит солей. Температура кипения исходной воды зависит от общего солесодержания.
Опреснение воды методом дистилляции осуществляется на испарительных установках различных конструкций с использованием разных источников тепловой энергии, стоимость которой составляет половину расходов на опреснение.
8.1.4.6. Опреснение воды вымораживанием
При замерзании минеральных вод соль и вода образуют отдельные структуры: сначала формируются кристаллы пресного льда, а на поверхности кристаллов сохраняется рассол. Наиболее приемлемые гидрофобные нетоксичные хладагенты: изобутан, бутан, фреоны, имеющие температуру кипения ниже 00 С.
8.1.4.7. Оценка качества опресненной и обессоленной воды
Вода должна соответствовать требованиям ГОСТ. Установление ПДК.
Минимальное солесодержание 100 мг/л. при употреблении воды с общим солесодержанием менее 50 мг/л – происходит нарушение водно – электролитного обмена и выведение из организма Cl-, Na+, K+, Ca2+. Оптимальное солесодержание 250 мг/л.
Обычно за эталон при подготовке питьевой воды из дистиллята берется вода Московского водопровода (общее солесодержание 250 мг/л).
Таблица 1
Дата добавления: 2020-02-05; просмотров: 889;











