Химические свойства алифатических и ароматических аминов.
Основность аминов.
Амины проявляют ярко выраженные основные свойства. Они являются донорами электронной пары (основания Льюиса), и в частности предоставляют пару электронов на свободную орбиталь Н+ (сродство к протону – основность по Бренстеду).
За счет +I эффекта алкильных групп, алифатические амины являются более сильными основаниями, чем аммиак. При увеличении количества алкильных групп (при переходе от вторичных к третичным аминам) основность насколько снижается за счет стерических затруднений доступности неподеленной пары электронов. Для циклических и каркасных аминов такой проблемы не существует и они в сравнении с открыто-цепными аминами, как привило боле сильные основания. Анилины обладают меньшими основными свойствами, чем алифатические амины. Это связано с частичным сопряжением неподеленной пары электронов азота с ароматическим кольцом, что приводит к уменьшению способности этой пары взаимодействовать с вакантной орбиталью кислоты. Донорные заместители в ароматическом ядре повышают основность анилинов, а акцепторные понижают. При наличии нескольких акцепторных групп в ароматическом кольце основные свойства пропадают и, например, 2,4-динитроанилин (pKa=–4,4) проявляет основные свойства только в среде концентрированной серной кислоты.
Алкилирование аминов.
Алкилирование аминов, как и получение аминов из аммиака и галоидных алкилов имеет очень ограниченное применение. В основном она используется для получения несимметричных четвертичных аммонийных солей. Последние, действием гидроксида серебра количественно переводятся в соответствующие четвертичные аммонийные основания.
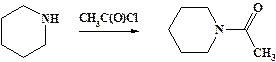 Ацилирование аминов.
Ацилирование аминов.
Первичные и вторичные амины, аналогично аммиаку, реагируют со сложными эфирами, галогенангидридами и ангидридами кислот с образованием N-замещенных амидов.
Третичные алифатические амины не вступают в реакцию с производными карбоновых кислот.
Взаимодействие аминов с альдегидами и кетонами.
Аммиак и первичные амины реагируют с альдегидами и кетонами с образованием иминов (оснований Шиффа).
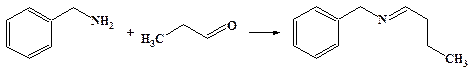
Вторичные амины в аналогичных условиях дают енамины.
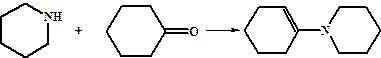
Обе эти реакции протекают по механизму присоединения по карбонильной группе. Третичные амины не вступают в реакции с альдегидами и кетонами.
Взаимодействие алифатических и ароматических аминов с азотистой кислотой. Соли диазония.
В зависимости от количества заместителей, алифатические амины в реакциях с азотистой кислотой могут образовывать крайне нестойкие соли диазония – первичные амины, N-нитрозоамины – вторичные амины или N-нитрозоаммонийные соли – третичные амины. По большей части эти реакции носят аналитический характер, так как позволяют с помощью простой качественной реакции различить первичные, вторичные и третичные амины.
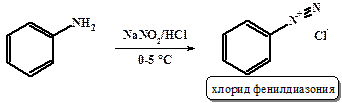 Первичные ароматические амины (анилины) легко реагируют с азотистой кислотой с образованием достаточно стабильных в растворах (около 0˚С) солей диазония. Как правило, акцепторные заместители в ароматическом ядре способствуют стабилизации солей диазония. Так, п-нитрофенилдиазоний устойчив в растворе уже при комнатной температуре.
Первичные ароматические амины (анилины) легко реагируют с азотистой кислотой с образованием достаточно стабильных в растворах (около 0˚С) солей диазония. Как правило, акцепторные заместители в ароматическом ядре способствуют стабилизации солей диазония. Так, п-нитрофенилдиазоний устойчив в растворе уже при комнатной температуре.
С помощью реакций замещения из ароматических аминов, через образование солей диазония, получаются все арилгалогениды нитрилы и нитроароматические соединения. Насколько особняком стоит реакция замены группы N≡N+ на F. В этой реакции (реакция Шиммана) источником фтора в данной реакции является комплексный анион BF4- или PF6-. Термическое разложение соли диазония с соответствующим противоионом приводит к замене диазо-группы на фтор. С помощью гипофосфита натрия или этилового спирта многие соли диазония восстанавливаются до ароматических углеводородов (реакция деаминирования).
Соли диазония, являясь электрофильными частицами, способны вступать в реакцию электрофильного замещения с некоторыми активными ароматическими субстратами – фенолами и анилинами. Эта реакция называется – азосочетание, а ее продукты азо-соедигнения.
Многие образующиеся в результате реакции азосочетания полициклические ароматические молекулы являются красителями (т.н. анилиновые красители).
Дата добавления: 2016-06-15; просмотров: 3722;











