Спектры поглощения окрашенных стёкол
Спектральная кривая окрашенного стекла характеризуется появлением избирательной или сплошной полосы поглощения в видимой области спектра.
Выделяют три группы красителей:
1) ионные;
2) молекулярные;
3) коллоидные.
Ионные красители. К ним относят катионы переходных и редкоземельных металлов – 3d и 4f - элементы. Особенность электронного строения этих элементов – наличие неспаренных электронов или незаполненных орбиталей. Данный краситель создаёт, как правило, типичные спектры поглощения в любой среде (прозрачные кристаллы, стекло, растворы).
Ti3+ – окрашивает стекло в коричневый цвет;
Ti4+ – не окрашивает стекло;
V3+ – зелёный цвет (к.ч.= 6);
V4+ – синий цвет (к.ч.= 6);
V5+ – не окрашивает (к.ч.= 4);
Cr3+ – зеленый цвет (к.ч.= 6);
Cr6+ – желтый цвет (к.ч.= 4);
Ce4+ – желтый цвет;
Mn2+ – слабо-розовый цвет;
Mn3+ – красно-фиолетовый цвет;
Nd3+ – красно-фиолетовый цвет;
Fe2+ – голубой цвет;
Fe3+ – желтый и коричневый цвета;
Co2+ – синий цвет (к.ч.= 4); розовый цвет (к.ч.= 6);
Ni2+ – фиолетовый цвет (к.ч.= 4); желтый цвет (к.ч.= 6);
Cu+ – не окрашивает;
Cu2+ – зелёный (к.ч.= 4), синий (к.ч.= 6);
Ce3+ – не окрашивает (к.ч.= 6, 8);
Ce4+ – жёлтый (к.ч.= 6, 8);
Pr3+ – желтовато-зелёный;
Nd3+ – красно-фиолетовый,
голубовато-фиолетовый;
Ионы-красители выполняют, в основном, функции модификаторов, располагаясь в полостях структурной сетки. Их окружение - мостиковые и немостиковые атомы кислорода.
Между разновалентными состояниями одного компонента в стекле устанавливается равновесие, определяемое составом стекла, температурой варки, окислительно-восстановительными условиями в расплаве и в газовой среде. Наиболее распространенной примесью в стекле являются оксиды железа. В стекле обычно присутствуют ионы как Fe2+, так и Fe3+, которые окрашивают стекло в различные оттенки зеленовато-желтого, голубого и коричневого цветов. Интенсивность окрашивания стекла трехвалентными ионами гораздо ниже, чем ионами двухвалентного железа. Поэтому стараются перевести катионы Fe2+ в Fe3+. Такое обесцвечивание стекла проводят за счет введения окислителей – это химическое обесцвечивание. Используют оксиды сурьмы, мышьяка, окислительную газовую среду.
При физическом обесцвечивании добавляют красители, дополняющие спектральное поглощение железа до нейтрального (кобальт и никель).
В стекловарении используют кварцевые пески с малой концентрацией оксидов железа. Так при производстве листового стекла содержание FeO < 0,15 мас.%. Однако при производстве тарного стекла, например, зеленого и коричневого для бутылок, допускается содержание FeO до 1,5 мас.%.
Молекулярные красители. К ним относятся сульфиды и селениды тяжелых металлов: Cd, Sb, Bi, Pb, Fe, Ag, Cu и др. В стекле они образуют монокристаллы размерами до 50 нм. Эти кристаллические включения равномерно распределяются в стекломатрице. Формирование микрокристаллической фазы осуществляется с помощью специальной технологической операции «доводки». Доводка предусматривает термообработку стекла при температурах, близких к температуре стеклования.
Поглощение света молекулярными красителями обусловлено возбуждением электронов валентной зоны и переброской их в зону проводимости соответствующего полупроводникового соединения. Ширина запрещенной зоны стекла ΔE1 значительно больше ширины запрещённой зоны выделившегося полупроводникового соединения ΔE2. Короткие волны полностью поглощаются, так как (hc)/λ > ΔE2.
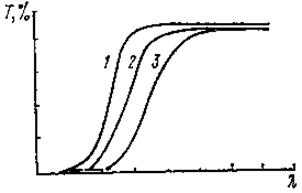
При выполнении условия 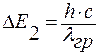 энергия кванта достаточна для его захвата окрашенным стеклом. Наступает интенсивное поглощение электромагнитных волн молекулярными красителями, что соответствует крутому нарастанию границы пропускания при увеличении длины волны электромагнитного излучения (рис. 4.15).
энергия кванта достаточна для его захвата окрашенным стеклом. Наступает интенсивное поглощение электромагнитных волн молекулярными красителями, что соответствует крутому нарастанию границы пропускания при увеличении длины волны электромагнитного излучения (рис. 4.15).
|
Рис. 4.15. Спектры пропускания (поглощения) стёкол,
содержащих различные молекулярные красители
При (hc)/λ < ΔE2 наблюдается высокое пропускание в области длинных волн.
Коллоидные красители. Окрашивание стекла основано на способности катионов меди, серебра, золота висмута и других тяжёлых металлов восстанавливаться до атомарного состояния с последующим объединением нейтральных атомов в частицы коллоидных размеров. Природа окрашивания – рассеяние света на коллоидных частицах металлов.
Цвет стекла зависит от разности показателей преломления стекловидной и дисперсной фаз, а также от размеров коллоидных частиц. В общем случае известно, что коллоидные частицы в зависимости от размера и разности показателей преломления могут обеспечивать достижение любого спектрального цвета. Полихромные стёкла получают на основе соединений серебра. Цвет стекла зависит от размеров кристалликов серебра (табл. 4.6).
Таблица 4.6
Цвет стекла, окрашенного коллоидными частицами серебра
| Размер частиц серебра, нм | Цвет стекла в отражённом свете |
| 0 – 25 | синий |
| 25 – 55 | зелёный |
| 35 – 60 | желтовато-зелёный |
| 70 – 130 | коричневый |
Стёкла, содержащие частицы меди, обычно имеют красный цвет (медный рубин), содержащие частицы золота – красно-фиолетовый и пурпурный цвет (золотой рубин), для частиц серебра характерен желтый цвет (серебряный рубин).
Дата добавления: 2018-11-26; просмотров: 2366;











