Раздел №5. Термодинамические условия проведения полимеризации.
Возможность протекания реакций определяется значением изменения энергии Гиббса в ходе реакции:
если ΔG>0, то реакция не протекает
если ΔG=0, то система находится в равновесии
если ΔG<0, то реакция может протекать.
Расчет изменения энергии Гиббса в ходе реакции может быть произведен по формуле:
ΔG=ΔH-TΔS (5.1.)
или
ΔG=ΔG˚+RTlnKp, (5.2.)
где ΔG˚=-RTlnKp-стандартный потенциалдля р = 1атм и Т = 293К
или ΔG˚=ΔH˚-TΔS˚ (ΔH˚ и ΔS˚ определяются по справочным данным).
Условие протекания реакции на один моль вещества можно также выразить через изменение химического потенциала, который отождествляется с изменением энергии Гиббса:
Δμ=ΔH-TΔS (5.3.)
(химический потенциал по определению представляет собой частные производные энергии Гиббса по характеристическим функциям при некоторых постоянных переменных).
На рисунке 5.1 изображены типичные зависимости изменения химического потенциала от температуры. Температурная зависимость определяется как 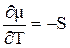 . Например для воды, поскольку Sпара > Sжидк.воды, то кривая 1 соответствует изменению для воды в парообразном состоянии (Вп), кривая 2 – для воды в жидком состоянии (Вж).
. Например для воды, поскольку Sпара > Sжидк.воды, то кривая 1 соответствует изменению для воды в парообразном состоянии (Вп), кривая 2 – для воды в жидком состоянии (Вж).
μ 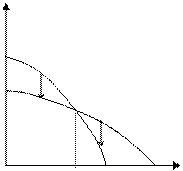
Ткип Вп Вж Т
Рис. 5.1. Зависимость изменения потенциала от температуры для воды
Чтобы процесс был термодинамически разрешен, необходимо, чтобы изменение потенциала было отрицательным, т. е. процесс протекал с уменьшением потенциала. Ниже Ткип μп>μж и пар конденсируется, выше Ткип μж>μп и жидкая вода превращается в пар.
Таким образом, самопроизвольно идут процессы перехода воды из одного состояния в другое в направлении, указанном на рисунке стрелками.
Рассмотрим возможные термодинамически разрешенные условия перехода мономеров в полимеры (процесс полимеризации).
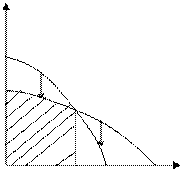 μ
μ
 |
Тпр М П Т
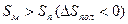
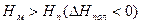
Рис. 5.2. Зависимость изменения потенциала от температуры (полимеризация возможна при температуре ниже Тпр)
В данном случае существует предельная температура, ограничивающая область полимеризации (на рисунке эта область заштрихована). При температурах, превышающих эту предельную температуру, полимеризация невозможна. Эта температура называется верхней предельной температурой.
Рассмотрим другой случай, когда область полимеризации лежит выше некоторой предельной температуры:
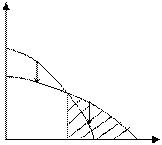 |
μ
Тпр П М Т
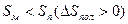

Рис. 5.3. Зависимость изменения потенциала от температуры (полимеризация возможна при температуре выше Тпр)
Температура, ограничивающая область полимеризации в данном примере называется нижней предельной температурой.
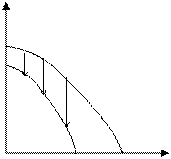
Возможны также случаи, когда полимеризация возможна во всей области температур (рис. 5.4. а), или невозможна вообще (рис. 5.4. б):
 |
 μ(а)μ(б)
μ(а)μ(б)
П М М П
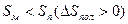
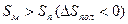
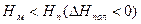

Рис. 5.4. Зависимость потенциала от температуры, когда полимеризация возможна во всей области температур (а), или невозможна вообще (б).
Процесс полимеризации можно условно представить в виде следующих стадий:
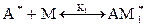 , где А* - активатор, М – мономер
, где А* - активатор, М – мономер
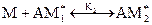
…………………………….
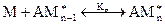
Можно принять, что константы равновесия на каждой стадии приблизительно равны друг другу (при n > >1):
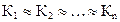
Константа каждой стадии равна:
 (5.4)
(5.4)
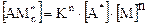 (5.5)
(5.5)
Определяем среднюю степень полимеризации:
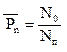 , (5.6)
, (5.6)
где
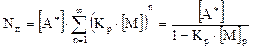 (5.7)
(5.7)
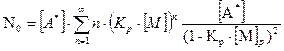 (5.8)
(5.8)
Получаем:
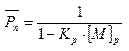 (5.9)
(5.9)
Т. к. степень полимеризации 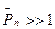 , то можно получить, что
, то можно получить, что 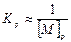
Полимерная молекула ведет себя как частица отдельной фазы, т.к. Кр не зависит от концентрации полимера. Например,

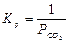
Учитывая приведенные выше допущения можно записать:
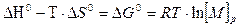 (5.10)
(5.10)
Откуда
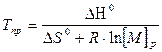 (5.11)
(5.11)
Это основное соотношение термодинамики полимеризации, связывающее равновесную концентрацию мономера, стандартные величины ∆Н° и ∆S° полимеризации и величину Тпр.
Рассмотрим влияние термодинамических ограничений на различные виды полимеризации.
1. Полимеризация с раскрытием кратных связей
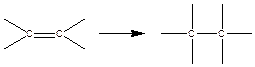
Тепловой эффект реакции полимеризации равен отрицательному значению изменения энтальпии:
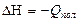 (5.12)
(5.12)
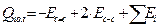 , (5.13)
, (5.13)
сумма первых двух членов составляет примерно 20-22 ккал/моль
Для реакции полимеризации этилена 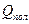 ≈ 20 ккал/моль, это максимальная величина для раскрытия связи:
≈ 20 ккал/моль, это максимальная величина для раскрытия связи: 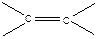
В случае α-метилстирола - 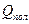 ≈ 8,5 ккал/моль.
≈ 8,5 ккал/моль.
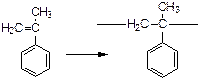
Снижение значения теплового эффекта происходит из-за стерического взаимодействия СН3
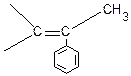 групп в соседних звеньях и из-за потери энергии сопряжения с группой
групп в соседних звеньях и из-за потери энергии сопряжения с группой 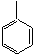 в мономере.
в мономере.
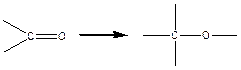
(полимеризация формальдегида, ацетальдегида).
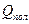 ≈2-3 ккал/моль, реакция также экзотермическая, но тепловой эффект небольшой.
≈2-3 ккал/моль, реакция также экзотермическая, но тепловой эффект небольшой.
Изменение энтропии при полимеризации:
 , где Sпол – абсолютная энтропия полимера, Sмон – абсолютная энтропия мономера, Sпот – потеря поступательной энтропии молекул мономера.
, где Sпол – абсолютная энтропия полимера, Sмон – абсолютная энтропия мономера, Sпот – потеря поступательной энтропии молекул мономера.
Полимеризация сопровождается уменьшением энтропии, а ΔSпол мало зависит от природы мономера.
В реакциях полимеризации этилена, метилметакрилата, формальдегида ΔH<0, ΔS<0, область полимеризации ограничивается верхней предельной температурой.
Для равновесной концентрации мономера при расчете верхней предельной температуры получаем:
при полимеризации этилена верхняя предельная температура равна 20000/25=800К=527˚С, термодинамические ограничения не влияют на проведение процесса;
при полимеризации α-стирола верхняя предельная температура равна 8500/25=340К=67˚С, реакция идет при температурах ниже 67˚С;
при полимеризации формальдегида верхняя предельная температура равна 3000/25=120К=-153˚С, реакция в растворе возможна только в условиях низких температур.
2. Полимеризация с раскрытием цикла
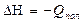 (5.14)
(5.14)
Пример реакции полимеризации с раскрытием цикла:
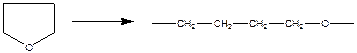
- раскрытие трехчленного цикла:
 -углы в цикле сильно деформированы (60˚, валентный - 119˚28΄), цикл является плоским.
-углы в цикле сильно деформированы (60˚, валентный - 119˚28΄), цикл является плоским.
при раскрытии трехчленного цикла освобождается энергия напряжения валентных углов в цикле, изменение энтропии отрицательно, Qпол>0 – реакция экзотермическая;
- раскрытие четырехчленного цикла:
 углы в этом цикле менее деформированы, чем в трехчленном, но реакция по-прежнему экзотермическая;
углы в этом цикле менее деформированы, чем в трехчленном, но реакция по-прежнему экзотермическая;
- раскрытие пятичленного цикла:
при раскрытии этого цикла также освобождается энергия деформации валентных углов, выделяется тепло, но тепловой эффект реакции очень мал, т. к. величины углов в цикле близки с равновесным углом в тетраэдре, т. к. углы в этом цикле почти равновесны:
При раскрытии цикла энергия практически не выделяется (Qпол ≈ 0);
- раскрытие шестичленных циклов:
 из-за образования устойчивых неплоских конформаций «ванна» (а) или «кресло» (б) углы в этом цикле очень близки к равновесным валентным.
из-за образования устойчивых неплоских конформаций «ванна» (а) или «кресло» (б) углы в этом цикле очень близки к равновесным валентным.
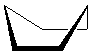

а б
нет выигрыша энергии при разрушении цикла, Q≈0;
- раскрытие семичленных циклов:
 появляются дополнительные напряжения в цикле за счет пространственных затруднений расположения заместителей, тепловой эффект снова возрастает.
появляются дополнительные напряжения в цикле за счет пространственных затруднений расположения заместителей, тепловой эффект снова возрастает.
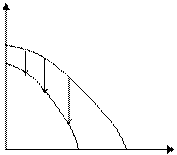
В результате получаем следующие зависимости термодинамических параметров реакции от числа звеньев в цикле:
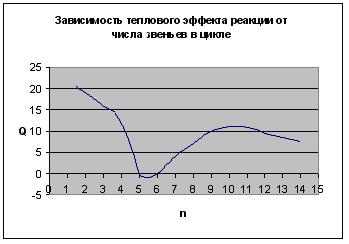
Рис. 5.5. Зависимость теплового эффекта реакции от числа звеньев в цикле
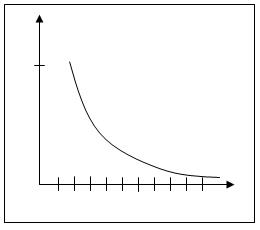
ΔS
энтр.
ед.
2 3 4 5 6 7 8 9 10 11 n
Рис. 5.6. Зависимость изменения энтропии при раскрытии различных циклов
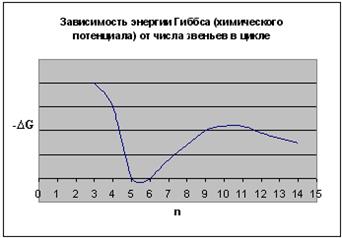
Рис. 5.7. Зависимость изменения энергии Гиббса (химического потенциала) при раскрытии различных циклов:
Таким образом, термодинамическая устойчивость циклов существенно зависит от их размера. Наиболее устойчивыми оказываются 5- и 6-членные циклы. При уменьшении и при увеличении размера циклов их склонность к полимеризации возрастает. Указанная закономерность была проиллюстрирована на примере ациклических систем. При введении одного или немногих атомов O, S, N в цикл рассмотренные закономерности сохраняются.
Вопросы для самостоятельной проработки:
1. Какими факторами определяется возможность протекания реакции полимеризации?
2. Что такое верхняя предельная температура полимеризации?
4. Что такое нижняя предельная температура полимеризации?
5. Как определить среднюю степень полимеризации?
6. Как влияют термодинамические ограничения на различные виды полимеризации?
7. Охарактеризуйте зависимость изменения энтропии при полимеризации.
Дата добавления: 2019-12-09; просмотров: 856;











