ПОЛУЧЕНИЕ И СВОЙСТВА КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Металлы и сплавы являются основным конструкционным материалом для машиностроения и приборостроения. К ним относятся химические элементы, простые и сложные вещества, обладающие характерными признаками:
1) низкой величиной относительной электроотрицательности, как следствие низких потенциалов ионизации и низкого сродства к электрону;
2) образуют только положительные центры;
3) в сложных ионах образуют также положительные центры.
Металлы и сплавы обладают рядом общих свойств. У атомов металлов на внешних электронных уровнях содержится небольшое количество электронов. Вследствие малой плотности электронов атомы металлов в процессе кристаллизации легко сближаются и обобществляют электроны. При перекрывании внешних орбиталей электроны мигрируют от одного атома к другому, осуществляя металлическую связь. В электрическом поле обобществленные электроны получают направленное движение и возникает электрический ток.
Для металлов характерна высокая теплопроводность, непрозрачность, металлический блеск, твердость, пластичность, способность (за исключением Hg) кристаллизоваться с образованием кристаллической решетки высокой симметрии: объемноцентрированный куб (о.ц.к.) (Nb, Ta, Pb, Cr и др.), гранецентрированный куб (Cu, Ni, Fe, Al, Ag, Au и др.), гексагональная плотная упаковка (Mg, Be, Cd, Zn, Ti, Zr и др.). Металлы могут быть легкими (для Li ρ = 0,5 г/см3) и тяжелыми (для Os ρ = 28 г/см3), легкоплавкими (для Hg – минус 390C, для Ga – 300C) и тугоплавкими (для W – 33900C). Для некоторых металлов характерно явление полиморфизма.
В зависимости от положения в периодической таблице (степени заполнения внешних и предвнешних уровней) все металлы делятся на s-, p-, d- и f- металлы.
Большинство металлов в природе находится в виде соединений с другими элементами. Только немногие металлы встречаются в природе в свободном состоянии, например Au, Hg, Ag, Pt, Cu (отчасти). Минералы и горные породы, содержащие соединения металлов в виде, пригодном для получения промышленным путем называются рудами.
Руды содержат металлы в виде оксидов, сульфидов, сульфатов, карбонатов, силикатов. галоидных соединений. Если в руде содержатся несколько металлов, то такие руды называются полиметаллическими.
Все методы получения металлов сводятся к процессу восстановления их из ионного состояния:
Меn+ + ne → Me0.
Основные способы получения металлов:
1. Вытеснение металла из его соединений более активным металлом (имеющим меньшее значение электродного потенциала (см. ряд напряжений)). Этот процесс может протекать в водных растворах – гидрометаллургия, а также в расплавах при высоких температурах – металлотермия. Впервые такой процесс был осуществлен при применении порошка алюминия для восстановления других металлов – алюмотермия. Al, Mg, Ca, Na отличаются высокой химической активностью и могут вытеснять другие металлы из их оксидов или соединений:
Cr2O3 + 2Al → 2Cr + Al2O3;
TiCl4 + 4Na → 4NaCl + Ti.
2. Восстановление металлов из их соединений газообразными СО и Н2 в присутствии твердого угля. Этот процесс осуществляется только при высоких температурах и называется пирометаллургией:
t,°C
MeO + CO → Me + CO2.
Данный процесс для некоторых металлов может сопровождаться образованием карбидов, тогда в качестве восстановителя используют водород:
t,°C
WO3 + 3H2 → W + 3H2O.
3. Электрометаллургия (электролиз) – разложение соединений под действием электрического тока. Данный процесс можно вести в водных растворах, а также в расплавах при повышенных температурах. Такой способ применим для получения металлов любой активности, но только из соединений ионного типа.
Пример. Схема электролизной системы и уравнения электродных процессов для получения цинка:
а) на графитовых электродах
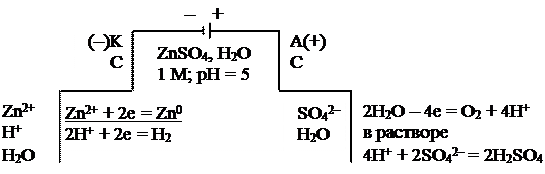 |
Суммарное уравнение электролиза:
2ZnSO4 + 2H2O = 2Zn + O2 + 2H2SO4
б) на цинковых электродах
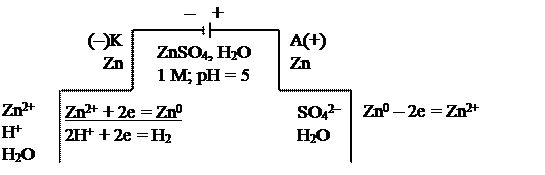 |
Схема электролиза на растворимых электродах (б) используется для:
– очистки металлов от примесей (электрорафинирование). В этом случае металл с примесями подключают к плюсу (+) внешнего источника (анод), к минусу (–) подключают чистый металл (катод), в качестве электролита используют водный раствор хорошо растворимой соли этого же металла;
– анодного травления (полировки) металлов и изделий из них. К плюсу (+) подключают изделие, требующее обработки;
– для получения покрытий. Изделие в данном случае подключают к минусу (–) внешнего источника тока (катод).
Для получения активных металлов проводят электролиз расплавов:
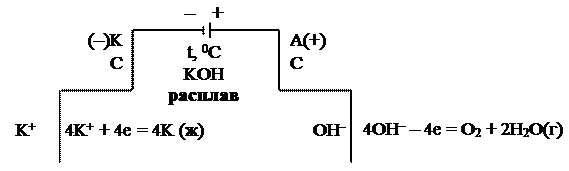 |
Суммарное уравнение электролиза:
4KOH → 4K + O2 + 2H2O(г)
Алюминий самый распространенный металл в земной коре (его содержание составляет ~ 8,8%), весьма активен (φ0Al3+/Al = – 1,67 В), поэтому в природе в свободном состоянии не встречается, а находится в виде соединений: бокситов Al2O3хH2O, алюмосиликатов K2O Al2O3 6SiO2 и т.д. Металлический алюминий – легкий металл, он почти в 3 раза легче железа, лучший проводник тепла и электричества после серебра и меди. Алюминий в технике получают электролизом расплава смеси, состоящей из чистого Al2O3 и криолита Na3[AlF6] при температуре 900-9500С. В расплаве Al2O3 диссоциирует на ионы:
Al2O3 → Al3+ + AlO33–.
На катоде выделяется алюминий, а на аноде разряжаются анионы и окисляют графитовые электроды:
2AlO33– – 6е = Al2O3 + 3О (на аноде);
3О + 3С = 3СО↑;
4Al3+ + 12е = 4Al (на катоде).
Алюминий устойчив на воздухе, в горячей и холодной воде. Не растворяется в концентрированных серной Н2SO4 и азотной HNO3 кислотах, так как на его поверхности образуется тонкая и очень прочная пленка Al2O3. Однако оксид алюминия Al2O3 проявляет амфотерные свойства, то есть взаимодействует с кислотами и щелочами:
Al2O3 + 6НCl = AlCl3 + 3H2O;
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Алюминий, лишенный оксидной пленки, весьма активен и взаимодействует с водой и разбавленными кислотами.
Алюминий – один из наиболее применяемых металлов в современной технике. Его используют как простое вещество, так и в разнообразных сплавах и соединениях. В частности, его сплав с магнием применяют как конструкционный материал для низкотемпературных ядерных реакторов. Будучи хорошим проводником электричества, применяется для изготовления электрических кабелей в различных электрохимических приборах. Алюминий не токсичен и находит широкое применение в пищевой и фармацевтической промышленности.
При протекании физико-химических процессов взаимодействия между металлами и растворами электролитов в ряде случаев могут протекать реакции вытеснения металлов из их соединений более активными металлами.
В результате на поверхности металлов осаждаются другие металлы, что приводит к образованию микрогальванических элементов, в которых металл с меньшим значением электродного потенциала φ0Me/Men+ является анодом, с большим значением φ0Me/Men+ – катодом. Такие процессы приводят, в конечном счете, к электрохимической коррозии активных металлов.
Несмотря на большое количество металлов (их более 80) свойства их не могут удовлетворить запросы новейшей техники. Поэтому в ряде случаев используются их смеси, находящиеся в расплавленном состоянии, при охлаждении которых образуются сплавы. В зависимости от характера и условий взаимодействия сплавы могут представлять собой механическую смесь кристаллов отдельных металлов, твердые растворы или химические соединения (интерметаллиды).
Пользуясь химическими методами можно установить качественный состав сплава. Для обнаружения катионов или анионов в сплаве их переводят с помощью аналитических (качественных) реакций в характерные осадки, или в растворимые окрашенные соединения, или в летучие соединения со специфическим запахом. Однако необходимо иметь в виду, что аналитические реакции указывают на наличие или отсутствие того или иного иона лишь при соблюдении определенных условий: концентрации раствора, реакции среды, температуры, времени.
Для обнаружения меди в сплаве необходимо нанести на образец 1-2 капли HNO3, затем через минуту нанести на это же место несколько капель раствора NH4OH. Синее окрашивание указывает на присутствие меди в сплаве.
Свинец в сплаве можно обнаружить действием концентрированной азотной кислотой (для перевода свинца в ионное состояние). Затем провести качественную реакцию с иодидом натрия или калия:
Pb2+ + 2I– → PbI2↓.
На поверхности сплава образуется соединение PbI2 желтого цвета.
Олово, находящееся в техническом припое, при действии концентрированной HNO3 образует белый осадок H2SnO3.
Реактивом на ионы Fe2+ является гексацианоферрат калия К3[Fe(CN)6]. Реакция сопровождается образованием турнбулевой сини:
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2.
турнбулевая синь
Для установления наличия ионов Fe3+ необходимо добавить роданид калия или аммония KCNS (NH4CNS). Образование роданида железа Fe(CNS)3 сопровождается окрашиванием раствора в красный цвет.
Для обнаружения серы в чугуне или стали, которая содержится в виде сульфидов FeS и других соединений, необходимо подействовать концентрированной 6н НCl и слегка подогреть. Выделение газа Н2S свидетельствует о наличии в сплаве серы. Если к выделяющемуся газу поднести фильтровальную бумагу, смоченную ацетатом свинца (СН3СОО)2Pb, то образование соединения PbS (черного цвета) подтверждает факт нахождения серы в исходном сплаве.
Дата добавления: 2022-02-05; просмотров: 382;











