Характеристика металлического состояния
Трудно переоценить значение металлов. Машины и механизмы, посуда и железнодорожные мосты, украшения и строительные конструкции – все это металлы. По многим оценкам металл относят к фундаментам цивилизации.
Обеспеченность металлом в значительной мере определяет уровень жизни людей, уровень развития науки и техники. Уникальный комплекс свойств металлических материалов – высокая прочность, пластичность, электропроводность, жаропрочность и др. обеспечивает широкое применение их в промышленно-экономическом комплексе, во всех отраслях науки и техники. По данным ООН, все другие вместе взятые неорганические материалы пока смогли заменить лишь 6 % металла.
Сейчас ежегодно добываются и используются в деятельности человека в мире многие миллионы тонн различных металлов: Fe около 300 млн т; Cu около 4 млн т; Al около 5 млн т; Zn, Pb около 2 млн т; Mg более 100 тыс. т; Ni, Sn около 200 тыс. т; Ti около 20 тыс. т; Mg, Bi, Cd, Co, Ag от 1 000 до 10 000 т; Au около 1 000 т; Pt около 10 т; Mn свыше 1 млн т; Cr не менее 200 тыс. т.
Что же такое металл? Как его отличить от неметаллов? Какие свойства являются характерными для металла? Физико-химические представления о металлах. Первое научное определение металла дано великим русским ученым М.В. Ломоносовым: «Металл – это светлое тело, которое ковать можно». В этом определении заложен глубокий физический смысл, вытекающий из особенностей атомного строения. В настоящее время металлами называют вещества, обладающие высокой электропроводностью и отрицательным термическим коэффициентом электропроводности.
Положительно заряженное ядро атома окружено отрицательно заряженными электронами, распределяющимися по энергетическим уровням: 1s2, 2s2, 2p6, 3s2, 3p6, (3d, 4s2), 4p6, (4d10, 5s2), 5p6, (5d10, 4f14), 6s2, (6d10, 5f14), 7s2.
Заполнение электронных уровней происходит в указанной последовательности. Для металлов характерным является наличие незаполненных уровней, наряду с полностью заполненными электронными уровнями. Электроны незаполненных уровней являются такими электронами, которые и образуют «электронный газ», обеспечивающий создание металлической связи.
Взаимодействие между положительными ионами и отрицательными коллективизированными электронами является основным фактором, определяющим металлическую связь. Ионы сохраняют постоянное положение и образуют пространственную решетку металла. Электроны, оторвавшиеся от атомов, свободно перемещаются между ионами. Считается, что электроны, оторвавшиеся от одних атомов, после некоторого перемещения вновь присоединяются к ионам, образуя нейтральные атомы, а затем вновь отрываются и т.д. Таким образом, в каждый момент времени определенная часть электронов может находиться в свободном состоянии.
Каждый из типов уровней, а именно уровни s имеют сферическую ориентацию, уровень p – гантелевидную, уровни d и f – эллипсоидальную. На внешней орбитали металлов обычно имеется 1 или 2 электрона. Переход электронов в коллективизированное состояние с внешней электронной орбитали приводит либо к сохранению формы внешней орбитали (если переходит в коллективизированное состояние 1 электрон), либо к оголению новой (нижней) орбитали. Это явление лежит в основе полиморфизма (аллотропического превращения) металлов, например, железа, марганца, кобальта, урана и других полиморфных металлов. Если после перехода электронов в коллективизированное состояние внешняя электронная оболочка – сферическая, то атомы упаковываются наиболее плотно, образуя одну из плотноупакованных решеток. Образование несферических орбиталей на поверхности атома приводит к формированию менее плотно упакованных решеток – обычно объемно-центрованных.
Чем больше оторвавшихся (коллективизированных) электронов, тем больше электропроводность металла. Коллективизированные электроны движутся в самых различных направлениях и поэтому в нейтральном кристаллическом металле нет направленного потока и результирующего переноса электричества. Но как только между двумя точками кристалла извне создается разность потенциалов, коллективизированные электроны металла устремляются в определенном направлении или, другими словами, в металле появляется электрический ток. Чем менее связаны коллективизированные электроны и чем больше их количество, тем выше электропроводность металла. У элементов с малым количеством коллективизированных электронов наблюдается пониженная электропроводность и пластичность. Так как объем электрона ничтожно мал по сравнению с пространством, занятым кристаллической решеткой, коллективизированные электроны можно сравнить с атомами или молекулами газа, и к ним до некоторой степени могут быть применены законы газового состояния. В связи с этим совокупность коллективизированных электронов называют электронным газом. Электронный газ играет роль матрицы, связывающей положительные ионы прочной связью в своих положениях в кристаллической решетке. При этом электронные силы притяжения между электронами и ионами уравновешивают силы отталкивания, действующие между одноименно заряженными ионами.
Высокая пластичность металлов, отмеченная М.В. Ломоносовым, также обусловлена наличием коллективизированных электронов электронного газа. Например: в ионных соединениях солей, обладающих высокой хрупкостью, взаимодействие атомов осуществляется за счет притяжения положительно и отрицательно заряженных ионов (рис. 1.3).

Рис. 1.3. Схема строения ионного кристалла и его поведение при сдвиге ионов друг относительно друга.
При воздействии на кристалл солей напряжений, вызывающих перемещение иона на долю междуатомного расстояния, происходит следующее: положительный ион, ранее находящийся в непосредственной близости с отрицательными ионами и притягивавшийся к нему, приближается к другому положительному иону и отталкивается от него. В результате возникают силы отталкивания между атомами, приводящие к хрупкому сколу кристалла.
В металлическом кристалле связь между ионами обеспечивается за счет перемещающихся частиц (электронов), не связанных с конкретным атомом. Поэтому смещение ионов на расстояния, соизмеримые с межатомными, не вызывает появления сил отталкивания.
При смещении слоя ионов перемещаются и электроны, поддерживая связь всего коллектива частиц, т.е. металлическому состоянию свойственна возможность смещения атомов из своего положения под действием силы извне без сколов, т.е. налицо явление пластичности.
Таким образом, физические свойства металлов, благодаря металлической связи в кристаллах, имеют свои особенности:
1. Более высокая электропроводность (на несколько порядков).
2. Уменьшение электропроводности с повышением температуры (у неметаллов с повышением температуры электропроводность растет).
3. Наличие у некоторых металлов явления сверхпроводимости при температурах вблизи абсолютного нуля.
4. Более высокая теплопроводность. Отличие в теплопроводности металлов и неметаллов значительно меньше, чем отличие в электропроводности. Например, теплопроводность серы всего в 3 раза меньше теплопроводности висмута и только на полтора порядка меньше теплопроводности железа.
5. Высокая пластичность металлов.
Кристаллическая структура металлов. Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур: А1 – кубическая гранецентрированная решетка (ГЦК), А2 – кубическая объемно-центрированная решетка (ОЦК), А3 – гексагональная плотноупакованная решетка (ГПУ). Подавляющее большинство металлов имеют кристаллические структуры трех видов – это решетки типа вольфрама, меди и магния.
Структурный тип меди (А1). Решетка Браве – гранецентрированная кубическая решетка (ГЦК).
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис. 1.4, а).
Элементарная ячейка 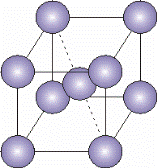 - ОЦК – объемно-центрированная кубическая
- ОЦК – объемно-центрированная кубическая
ГЦК – гранецентрированная кубическая

ГПУ – гексагональная плотноупакованная
ГЦК γ-Fe, Ni, Cu, Au, Pt
ОЦК α-Fe, W, Mo
ГПУ Mg, Y, La
Параметр решетки 0,2-0,6 нм. Коэффициент компактности решетки.

Рис. 1.4. Гранецентрированная кубическая решетка (а), размещение в ней октаэдрических (б) и тетраэдрических (в) пустот; г – расположение плотноупакованных плоскостей и направлений (111).
Каждый атом в этой решетке окружен 12 ближайшими соседями, располагающихся на одинаковых расстояниях, равных a / 2 = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12, называется координационным числом кристаллической решетки. Кристаллическая ГЦК-решетка имеет два вида пустот (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах), образующих твердые растворы внедрения.
Наибольшие пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК-решетки, занимающими места в вершинах правильного октаэдра, поэтому они называются октаэдрическими пустотами (рис. 1.4, б). Тетраэдрические пустоты имеют радиус, равный 0,41 r, где r – радиус атома. Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке γ-Fe.
Кроме этих пустот в ГЦК-решетке имеются более мелкие пустоты, называемые тетраэдрическими, поскольку их окружают 4 атома. Всего в ГЦК-решетке 8 тетраэдрических пустот радиусом 0,41 r и 0,225 r (рис. 1.4, в).
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба, чередующиеся в последовательности АВСАВС…, являются плоскости {111} (рис. 1.4, г). В этих плоскостях содержатся направления <110 > с плотноупакованными рядами атомов.
Кубической гранецентрированной решеткой ГЦК обладают следующие металлы: γ-Fe, Al, Cu, Ni, α-Co, Pb, Ag, Au, Pt и др.
Структурный тип вольфрама (А2). Решетка Браве является объемноцентрированной кубической решеткой (ОЦК), решетка ОЦК является менее плотноупакованной.
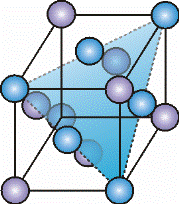
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рис. 1.5). Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии  aÖ 3 = 0,866 × a, где, а – длина ребра куба. Следовательно, координационное число решетки равно 8.
aÖ 3 = 0,866 × a, где, а – длина ребра куба. Следовательно, координационное число решетки равно 8.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рис. 1.5, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рис. 1.5, г). Если структуру ОЦК-решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические – 0,154 r.
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК. Внедрение других атомов в октаэдрическую пору ОЦК-решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки α-Fe.

Рис. 1.5. Объемно-центрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей и направлений (110) (б); тетраэдрических (в) и октаэдрических (г) пустот.
Примесные атомы внедрения, располагающиеся в междоузлиях ОЦК, чаще всего занимают меньшие по объему октаэдрические пустоты, т.к. это приводит к меньшему искажению решетки по сравнению с нахождением в тетраэдрических пустотах.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства {110} (рис. 1.5, б). В этих плоскостях имеются 2 направления <111>, в которых жесткие шары могут соприкасаться.
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы α-Fe, хром, вольфрам, молибден, ванадий, натрий, литий и др.
Структурный тип магния (А3) – гексагональная плотноупакованная решетка А3 (ГПУ, ГП, ГК). Решетка Браве – гексагональная примитивная.
Плотная упаковка обеспечивается дополнительным слоем атомов, расположенным внутри шестигранной призмы. Гексагональная решетка построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояниях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рис. 1.6).
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки – через с. Шесть ближайших соседей, расположенных в смежных слоях, будут также находиться на расстоянии а от данного атома, если отношение осей с/а составит 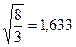 , то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае так же, как и в ГЦК-решетке, равно 12.
, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае так же, как и в ГЦК-решетке, равно 12.

Рис. 1.6. Гексагональная плотноупакованная решетка (ГПУ): а – расположение атомов; б - выделенные типы пустот в решетке: октаэдрическая (вверху) и тетраэдрическая (внизу).
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси «с». В гексагональной плотноупакованной решетке так же, как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рис. 1.6, б). Диаметры жестких сфер, которые могут быть помещены в эти пустоты, так же, как и для ГЦК, равны 0,41 r и 0,225 r.
Плотнейшие слои атомов типа {0001} располагаются в последовательности АВАВ… В каждой такой плоскости имеется три плотноупакованных направления типа <1120>.
Гексагональной плотноупакованной решеткой обладают такие металлы, как Zn, β-Co, Cd, Mg, α-Ti, α-Zr, Sc, Be.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК-решетки {111} (рис. 1.7, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК-решетке: …АВСАВС… (рис. 1.7, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна, поэтому последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, называемых дефектами упаковки. Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рис. 1.7).

Рис. 1.7. Схема расположения плотноупакованных атомных слоев в решетках: а – ГПУ; б – ГЦК.
Углерод в виде алмаза, кремний, германий, α-олово (серое) имеют кубическую решетку типа алмаза (рис. 1.8). Она отличается от ГЦК-решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате структура оказывается более рыхлой. Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией. Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела при нагреве или при охлаждении. В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы α-Fe с ОЦК-решеткой в высокотемпературную форму γ-Fe с ГЦК-решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С γ-Fe в δ-Fe с ОЦК- решеткой, аналогичной α-Fe. Аллотропические превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной формой являются α-Ti, α-Zr с ГП-решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются β-Ti и β-Zr, обладающие ОЦК-решеткой.
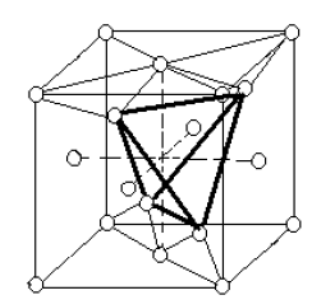
Рис. 1.8. Кристаллическая решетка алмаза.
Характеристика реального металла. Расчетами теоретической прочности металлов, основанными на классической теории, представляющей металл идеально построенным конгломератом, в котором атомы занимают строго определенные места в кристаллических решетках, показано, что реальная прочность металлов в десятки и сотни раз ниже теоретической.
Прочность технически чистого металла составляет 250–300 МПа, тогда как теоретическая прочность ее должна быть порядка 15 000 МПа.
Причиной такого снижения прочности является отклонение порядка расположения атомов в кристаллических решетках металла от идеального расположения, рассмотренного выше. Реальный металл всегда не идеально чистый, и присутствующие в металле примеси, даже в очень небольших количествах, приводят к появлению дефектов кристаллического строения металла. Физические нарушения (дефекты) твердых металлов обусловлены отклонением от правильного идеального расположения атомов в решетке металлов.
Даже идеально построенный единичный монокристалл имеет дефекты, т.к. он имеет грани. В силу поверхностного натяжения решетка на поверхности металла и в прилегающих участках оказывается искаженной. Еще более искаженными оказываются решетки поликристаллических тел в зонах границ зерен. Границы зерен – один из видов дефектов кристаллического строения.
Более тонкими нарушениями кристаллического строения является субзеренная структура металлов. Если идеально построенный монокристалл или кристаллит поликристалла можно представить в виде идеальной сетки, то фактическая кристаллографическая ориентировка в зернах идеального кристалла отличается от идеальной, образуя так называемую субзеренную структуру зерна (рис. 1.9).

Рис. 1.9. Схема субзеренного строения зерна.
Участки с одинаковой ориентировкой называются здесь субзернами. Они ориентированы относительно друг друга на очень небольшой угол (порядка нескольких угловых секунд или минут). Размеры субзерен – 10-4–10-5 см.
Границы между субзернами являются дефектами кристаллографического строения и называются субзеренными границами. Границы зерен и субзеренные границы относятся к поверхностным (двухмерным) дефектам.
Включения вторых фаз в сплаве, а также микропоры представляют собой класс объемных (трехмерных) дефектов. Эти дефекты оказывают значительное влияние на механические и физические свойства металлов и сплавов, однако решающее значение в этом отношении имеют точечные (нульмерные) и линейные (одномерные) дефекты.
К точечным дефектам относятся вакансии и дислоцированные атомы (рис. 1.10). Вакансии и междоузельные атомы играют решающую роль в процессах диффузии, но могут влиять и на механические свойства. Наличие вакансий в решетке сообщает атомами подвижность, т.е. позволяет им перемещаться в процессах диффузии и самодиффузии в металлах и сплавах.
Вакансия образуется путем выхода атома, находящегося в верхней атомной плоскости кристалла, на поверхность, вследствие чего образуется вакансия на поверхностном слое, в которую может перейти любой из соседних атомов, образуя новую вакансию и т.д. Таким образом, путем перескока атома на место существующей вакансии, она перемещается в объеме кристалла, сообщая атомам необходимую в процессах диффузии подвижность.
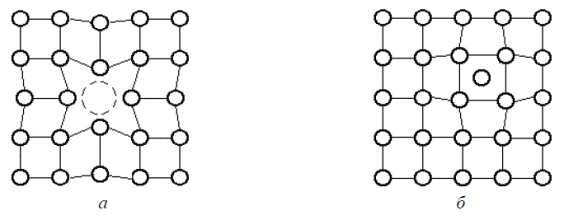
Рис. 1.10. Схема точечных дефектов в атомном строении металлов: а – вакансия; б – дислоцированный атом
Количество вакансий в каждом металле является строго определенной величиной, зависящей от температуры.
Дислоцированные атомы образуются в результате перескоков из своего регулярного положения в ближайшее междоузлие. Эти перескоки могут осуществляться в результате локальных повышений температуры и напряжений, сообщающих отдельным атомам энергию, повышающую среднюю тепловую энергию всех атомов. Вероятность образования дислоцированных атомов по сравнению с вакансиями значительно меньше, поэтому и концентрация дислоцированных атомов всегда значительно меньше, чем вакансий. При наличии в сплаве обоих типов точечных дефектов может происходить их взаимодействие, в результате которого уменьшается число дефектов решетки.
К линейным дефектам относятся дислокации. Выделяют два основных вида линейных несовершенств: краевые и винтовые дислокации. Краевые дислокации в кристалле возникают в том случае, если часть кристалла по всей плоскости скольжения под действием напряжений сдвигается относительно другой его части на некоторую величину, соизмеримую с межатомным расстоянием или его частью (рис. 1.11).
Графически краевая дислокация представляет собой структурное несовершенство кристаллической решетки, вызванное в ней присутствием в ней «лишней» атомной полуплоскости (экстраплоскости). Эта плоскость перпендикулярна плоскости рисунка. Область, находящаяся вблизи края экстраплоскости, называется ядром дислокации. В ядре дислокации наблюдается наибольшее искажение кристаллической решетки: выше кромки экстраплоскости решетка оказывается сжатой, ниже – растянутой, а по бокам сдвинутой.
Длина линии дислокации в плоскости, перпендикулярной рисунку, имеет тот же порядок, что макроскопические размеры кристалла. Часто дислокации распространяются через весь кристалл. Поперечные размеры дислокации весьма малы (в радиусе порядка десяти межатомных расстояний).
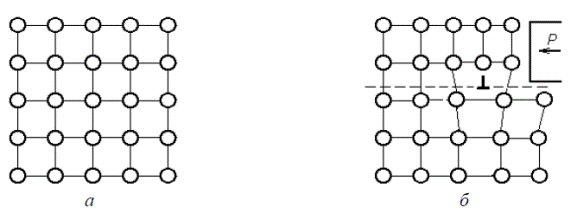
Рис. 1.11. Схема образования краевой дислокации После появления дислокации продолжение длительности действия напряжений приводит к перемещению краевой дислокации в плоскости скольжения в направлении действия напряжения, называемого вектором сдвига.
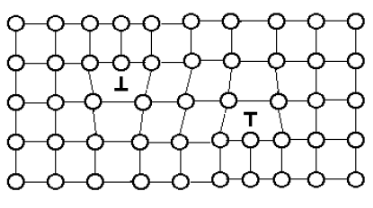
Рис. 1.12. Положительная и отрицательная краевые дислокации в кристалле.
Различают положительные краевые дислокации, если сдвигается верхняя часть кристалла, и отрицательные, если сдвигается его нижняя часть (рис 1.12).
Взаимодействие разноименных дислокаций, сдвигающихся в одной плоскости скольжения, может приводить к аннигиляции дислокаций, к изменению количества дефектов решетки.
Основными характеристиками дислокаций являются вектор сдвига, называемый вектором Бюргерса, и направление линии дислокации.
Вектор Бюргерса является основной количественной энергетической характеристикой дислокации. Вектор Бюргерса, с одной стороны, отражает способность дислокации при своем движении вызвать пластический сдвиг данной величины и направления, а с другой стороны, является мерой искаженности кристаллической решетки, содержащей дислокацию. Линия краевой дислокации перпендикулярна вектору сдвига. Следовательно, образующаяся в металле под действием возникающих внутренних напряжений краевая дислокация может двигаться параллельно самой себе в плоскости скольжения в направлении, перпендикулярном линии дислокации.
Винтовая дислокация образуется при сдвиге одной части кристалла относительно другой не одновременно по всей плоскости скольжения (рис. 1.13). В этом случае наиболее искаженную кристаллическую решетку получают микрообъемы металла на линии, параллельной вектору сдвига. При этом вокруг такой линии атомные плоскости оказываются изогнутыми по винтовой линии. Радиус воздействия дислокации на эти плоскости находится в пределах нескольких десятков межатомных расстояний.

Рис. 1.13. Сравнение краевой (а) и винтовой (б) дислокаций
У винтовой дислокации, в отличие от краевой, линия дислокации параллельна вектору Бюргерса, а направление перемещения дислокации перпендикулярно ему (рис. 1.13). Винтовые дислокации также могут иметь разные знаки, в этом случае они называются правой и левой дислокаций. При встрече разноименных винтовых дислокаций может иметь место их аннигиляция.
Как винтовая, так и краевая дислокации в идеальном случае являются прямолинейными несовершенствами. Однако в реальном металле могут иметь место криволинейные дислокации, составленные из нескольких краевых и винтовых дислокаций. Такая дислокация называется смешанной.
Для чего необходимо знание дефектов кристаллического строения (и в частности дислокаций) для специалистов различных специальностей? Оказывается, что дислокации принимают непосредственное участие во всех структурных и фазовых превращениях в металлах и сплавах и оказывают значительное влияние на их свойства. Тщательное изучение субзеренных границ и границ зерна показывает, что они являются скоплениями несовершенств кристаллического строения, и в наибольшей степени дислокаций (рис. 1.14).
На рисунке приведена схема субзеренной границы, составленной из краевых дислокаций. Воздействуя каким-либо образом на количество дислокаций, можно увеличить степень разориентировки субзерен, уменьшить их размеры или размер зерна, тем самым оказывая непосредственное влияние на физико-механические свойства металлов и сплавов. С одной стороны, управляя механизмом перемещения дислокаций в металлах, воздействуя на их подвижность, можно вызывать упрочнение или разупрочнение сплавов. С другой стороны, количество дислокаций в материале, их взаимодействие и распределение определяет поведение материала в изделии под действием эксплуатационных нагрузок и температурных воздействий. Выходы дислокаций на поверхность кристалла и внешнюю поверхность изделия повышают химическую активность материала, снижают его коррозионную стойкость. Дислокации являются катализаторами выделения избыточных фаз в сплавах, воздействуя на процессы распада пересыщенных твердых растворов и иные процессы фазовых превращений.
Рассмотренные дефекты кристаллической решетки, как мы видим, приводят к ее искажениям. Эти искажения вызывают рост энергии кристалла.
Обычно эту добавочную энергию условно выражают в виде напряжений. Согласно классификации внутренних напряжений, предложенной Н.Н. Давиденковым, их классифицируют как напряжения I, II, и III рода. К микронапряжениям II рода относятся остаточные напряжения, уравновешивающиеся в объемах отдельных зерен или субзерен. Эти напряжения возникают в результате наличия средней деформации кристаллических решеток, составляющих объемы соответствующих зерен или субзерен. Наличие напряжений II рода приводит к размытию рентгеновских линий на рентгенограмме. Величина размытия линий определяет величину напряжений II рода.
К микронапряжениям III рода относят остаточные напряжения, возникающие в результате отклонений атомов в кристаллической решетке от идеального положения вокруг единичных дефектов кристаллической решетки (точечных или линейных). Эти напряжения уравновешиваются в объемах с радиусом, соизмеримым с одним или несколькими межатомными расстояниями в кристаллической решетке.
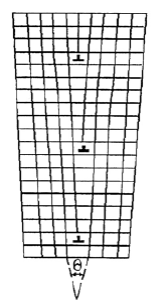
Рис. 1.14. Схема образования субзеренной границы.
Основная масса микронапряжений сосредоточена в пограничных зонах: по границам блоков, кристаллов, а также в зонах кристаллов, в которых наблюдается повышенная плотность дислокаций.
Напряжения I рода – макроскопические, возникающие в результате наиболее грубых дефектов в металлах. Эти напряжения уравновешиваются в объемах, соизмеримых с объемом тела или его макроскопических зон. Наиболее ответственными за изменение физико-механических свойств металлов и сплавов являются напряжения II и III рода, в первую очередь III рода, тогда как макронапряжения (I рода) отвечают за способность изделий надежно работать без разрушения в условиях эксплуатации под действием динамических нагрузок, усталостного разрушения и в иных сложных ситуациях.
Дата добавления: 2021-12-14; просмотров: 363;











