Типы химической связи.
Строение, свойства и методы исследования металлов и сплавов
Атомы любого вещества состоят из положительно заряженного ядра и отрицательно заряженных электронов, распределяющихся по энергетическим уровням. В зависимости от взаимодействия молекул, атомов, ионов и электронов в атомной структуре материалов встречается несколько типов химической связи: ионная, ковалентная, молекулярная, металлическая.
Ионная связьобусловлена переходом электронов от одного атома к другому, в результате чего образуется электростатическое притяжение между положительными и отрицательными ионами. Данная связь характерна для солей и оксидов (NaCl, MgO, LiF), это направленная прочная связь, ограничивающая движение электронов. Ионным кристаллам свойственна малая электропроводность при низких температурах, электрический ток в ионных кристаллах обеспечивается направленным потоком ионов (ионная проводимость) (рис. 1.1, а).
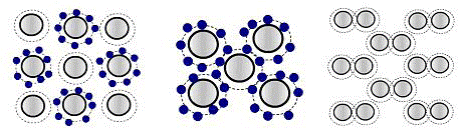
а б в
Рис. 1.1. Основные типы связей: а – ионная (NaCl); б – ковалентная (алмаз); в – молекулярная (Ван-дер-Ваальсовая)
Ковалентная (гомеополярная) связьвозникает в результате того, что электроны, находящиеся на внешнем энергетическом уровне примерно равномерно распределены между соседними атомами. Поэтому каждый атом связан с соседним атомом парой валентных электронов (рис. 1.1, б). Силы притяжения между атомами слабее, чем при ионной связи, однако ковалентная связь является сильно направленной, она определяет прочное взаимное расположение атомов. Ковалентные кристаллы характеризуются высокой температурой плавления, большой твердостью и малой электропроводностью, которая, как и у кристаллов с ионной связью, растет с повышением температуры. В ковалентных кристаллах, в отличие от ионных, электропроводность связана с направленным движением электронов. Ковалентную связь между атомами имеют Si, Ge, C (с решеткой алмаза).
Молекулярная связьхарактеризуется тем, что в узлах кристаллической решетки находятся устойчивые молекулы. Атомы внутри молекул сильно связаны, а между молекулами силы взаимодействия (силы Ван-дер-Ваальса) слабые и осуществляются за счет определенного смещения центров электрических зарядов в целом нейтральных молекул и их кулоновского притяжения (рис. 1.1, в). Молекулярные кристаллы имеют низкую температуру плавления и легко переходят из твердого состояния в газообразное. Такая связь наблюдается в твердом водороде, а также в отвердевших инертных газах.
Металлическая связьвозникает, когда атомы в решетке максимально плотно упакованы (модель жестких шаров). В результате электрические поля атомных ядер перекрываются. Электроны, находящиеся на внешних энергетических уровнях атомов под воздействием этих полей теряют связь со своими атомами и становятся коллективными (свободными). В результате решетка металлического кристалла будет состоять из закономерно расположенных в пространстве положительных ионов и свободных электронов (рис. 1.2).

Рис. 1.2. Металлическая связь: 1 – атомное ядро; 2 – атомный остов; 3 – обобщенные электроны.
Металлическая связь ненаправленная, электроны свободно перемещаются в решетке, обеспечивая высокую электро- и теплопроводность. У металлических кристаллов электропроводность падает с повышением температуры, т.е. они имеют отрицательный температурный коэффициент электропроводности. Неметаллы (металлоиды), в отличие от металлов, имеют положительный температурный коэффициент электропроводности, электропроводность растет при повышении температуры. К металлам относятся Na, Al, Fe, Mg, Cr, W, Ti, Ni и другие; к неметаллам – газы (H, N, O, F, Cl), твердые кристаллы (B, C, Si, P, S, As).
Некоторые кристаллы занимают промежуточное положение между идеальными типами. Например, некоторые фазы обладают металлической проводимостью, но имеют ковалентные связи. Так, при легировании железа кремнием помимо основной металлической связи возникает дополнительно ковалентная связь.
Дата добавления: 2021-12-14; просмотров: 330;











