Скорости молекул. Распределение молекул по скоростям
Для характеристики скорости теплового движения выразим среднюю квадратичную скорость молекулы через температуру газа Т. Средняя кинетическая энергия ‹ε0› поступательного движения молекулы массой m0, с одной стороны равна
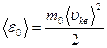 (8.19)
(8.19)
С другой стороны, эта энергия может быть определена через температуру
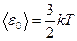 (8.20)
(8.20)
Сопоставляя (8.19) и (8.20), получим среднюю квадратичную скорость молекулы идеального газа
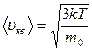 (8.21)
(8.21)
Полученную скорость часто называют просто тепловой скоростью, так как в формулу (8.21) вместо m0 c успехом можно подставить массу атома, молекулы или броуновской частицы. Применяя формулу (8.21) к молекулам, ей удобно придать другой вид. Учитывая, что  , получим
, получим
 (8.22)
(8.22)
где, R – молярная газовая постоянная;
m = m0 Na – масса газа (Na – число Авогадро).
Скорости движения молекул в газе различны. Но, согласно, молекулярно-кинетической теории, какие бы ни были скорости, для газа определенной температуры средняя квадратичная скорость молекул массой m0 находящихся в состоянии равновесия остается величиной постоянной и определяется по формуле (8.21) или (8.22).
Это объясняется тем, что в газе, находящимся в состоянии равновесия, устанавливается некоторые стационарные не изменяющиеся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Этот закон теоретически вывел Максвелл[8].
Задача о статистическом распределении молекул по скоростям сводиться к установлению числа молекул, которые обладают скоростями, лежащими в интервале u, u + du. Это количествомолекул dN прямо пропорционально общему количеству молекул N, ширине интервала du и зависит от величины скорости
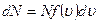 (8.23)
(8.23)
где ƒ(u) – функция распределения молекул газа по скоростям;
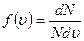 – показывает относительное число молекул, приходящихся на единицу интервала скоростей.
– показывает относительное число молекул, приходящихся на единицу интервала скоростей.
Функция ƒ(u) для равновесных состояний газа вычислена теоретически и проверена путем измерений. По Максвеллу она имеет вид
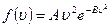 (8.24)
(8.24)
где А и В – постоянные, зависящие от массы и температуры
 ,
, 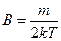
Графики ƒ(u) для разных температур представлены на рис.8.2.
Площадь заштрихованной части при малых значениях du будет  , т.е. равна доле общего числа молекул, обладающих скоростью, лежащей в интервале от u до u + du.
, т.е. равна доле общего числа молекул, обладающих скоростью, лежащей в интервале от u до u + du.
Скорость uв, соответствующая максимуму кривой, называетсянаиболее вероятной скоростью.Значениеuв можно найти, продифференцировав выражение по аргументу и приравняв результат нулю, используя условия для максимума функции ƒ(du)
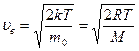 (8.25)
(8.25)

Рис.8.2.
Из графика видно, что наибольшая площадь находится под максимумом кривой. Следовательно, наиболее вероятная скорость близка к скорости большинства молекул.
Из закона распределения (8.24) можно найти среднюю арифметическую скорость ‹u› поступательного движения молекул идеального газа
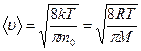 (8.26)
(8.26)
Все представленные скорости молекул характеризуют состояние идеального газа и близки друг к другу, т.е. их соотношение: ‹uв›:‹uкв›:‹u› = 1:1,1:1,2.
[1] Существуют и другие температурные шкалы, например, в Америке и Англии температуру измеряют по шкале Фаренгейта (°F), в которой температуре замерзания воды соответствует 32°F, а температуре кипения воды 212°F.
2 Цельсий (Celsius) Андерс (1701 – 1744) – шведский астроном и физик
3 Кельвин (Kelvin) (1824 – 1907) – английский физик. Настоящая фамилия Томсон Уильям Кельвин, получил титул барона за научные заслуги.
4 Клапейрон (Clapeyron) Бенуа Поль Эмиль (1799 – 1864) - французский физик.
5 Менделеев Дмитрий Иванович (1834 – 1907) – русский химик.
1Авогадро (Avogadro) Амедео (1776 – 1856) – итальянский физик и химик
2 Больцман (Bolzmann) Людвиг (1844 – 1906) - австрийский физик.
[8] Максвелл (Maxwell) Джеймс Клерк (Clerk) (1831-1879) – английский физик.
Дата добавления: 2019-12-09; просмотров: 281;










