Термодинамические параметры
Молекулярно-кинетический и термодинамический методы
При изучении строения веществ и их свойств используют два метода:
– молекулярно-кинетический (молекулярно-статистический);
– термодинамический.
Молекулярно-кинетический метод исходит из того, что все тела состоят из молекул и атомов, которые находятся в хаотическом (броуновском) движении. Идея об атомном строении вещества высказана еще Демокритом. Основы молекулярно-кинетической теории заложены М.В.Ломоносовым. Дальнейшее развитие этой теории относится к середине ХIХ века и связано с трудами Р.Клаузиса, Дж.Максвелла и Л.Больцмана. Молекулярно-кинетическая теория отвечает на вопросы, относящиеся к свойствам вещества – что происходит внутри тел, когда меняется их температура, когда они плавятся или испаряются и т.д.
Молекулярно-кинетический подход рассматривает поведение отдельных молекул, а, следовательно, все явления, происходящие с веществом в целом как статистический результат явлений, происходящих с отдельными молекулами. Используя статистический метод и теорию вероятности, устанавливают законы, описывающие состояние вещества. Давление, температура рассматриваются как статистический результат действия всех молекул.
В молекулярно-кинетической теории пользуются моделью идеального газа, которая удовлетворяет трем условиям:
1. считается, что собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором находится газ;
2. отсутствуют силы взаимодействия между молекулами;
3. столкновения молекул между собой и со стенками сосуда считаются абсолютно упругими.
Раздел физики, который основывается на молекулярно-кинетической теории, называется молекулярной физикой.
Термодинамический метод изучает макроскопические свойства веществ и основывается на изучении различных превращений энергии. Раздел физики, в котором физические свойства вещества изучаются с помощью термодинамического метода, называется термодинамикой. Термодинамика основывается на трех фундаментальных законах (началах).
Молекулярно-кинетическая теория и термодинамика дополняют друг друга, образуя по существу одно целое.
Термодинамические параметры
При изучение свойств вещества термодинамическим методом используют понятие термодинамической системы, под которой понимается совокупность макроскопических тел (или составляющих тело частиц), взаимодействующих и обменивающихся энергией как между собой, так и с другими телами, не входящими в состав данной системы (внешними телами).
Состояние системы характеризуется физическими величинами, называемые термодинамическими параметрами (или параметрами состояния): давлением Р, объемом V и температурой T.
Рассмотрим термодинамическую систему, представляющую собой газ массой m.Вследствие непрерывного хаотического движения молекулы газа оказывают давление на стенки сосуда
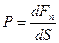 (8.1)
(8.1)
если сила постоянная
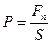 (8.2)
(8.2)
S – площадь стенок сосуда, Fn – проекция силы действия молекул на нормаль к площадке.
Единицы измерения давления – паскаль: 1 Па = 1 Н/м2.
Удельный объем, т.е. объем, занимаемый газом массой m = 1 кг, определяется как
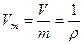 (8.3)
(8.3)
V – объем, занимаемый газом массой m
ρ – плотность газа.
Для однородного тела (ρ = const) удельный объем равен объему тела единицы массы. Поэтому однородное тело можно характеризовать объемом V.
Температура Τ – физическая величина, характеризующая состояние термодинамической системы, является мерой интенсивности теплового движения частиц (молекул, атомов, ионов) системы.
В соответствии с решением XI Генеральной конференции по мерам и весам измеряют температуру по одной из двух температурных шкал – термодинамической (абсолютной) и Международной практической[1]. В Международной шкале температур в качестве реперных точек (точек отсчета) приняты температуры замерзания и кипения воды при давлении 1,013×105 Па. Они приняты соответственно за 0°С и 100°С; температура, измеренная по шкале Цельсия[2] (°С) обозначается t.
В термодинамической температурной шкале в качестве реперной точки принята тройная точка воды – температура, при которой лед, вода и насыщенный пар находятся в состоянии термодинамического равновесия. Температура этой точки при давлении 1,013×105 Па соответствует -273,15°С. Температура, измеренная по шкале Кельвина[3] (K) обозначается T.
Один градус по шкале Кельвина соответствует одному градусу по шкале Цельсия. Таким образом, значения температур по этим шкалам связаны соотношением
T = t + 273,15 (8.4)
Изменение хотя бы одного из параметров приводит к изменению других и называется термодинамическим процессом. Если термодинамические параметры остаются неизменными в течение некоторого времени, то говорят, что система находится в состоянии термодинамического равновесия.
Для идеального газа при изменении одного из параметров другие также изменяются. Параметры связаны уравнением Клапейрона[4]
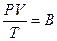 (8.5)
(8.5)
где В – газовая постоянная, ее значение для различных газов различно.
Применив уравнение Клапейрона для одного моля газа Vm Менделеев[5] получил уравнение, которое носит название уравнение Менделеева-Клапейрона
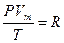 (8.6)
(8.6)
где, R – молярная газовая постоянная.
Число молей 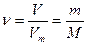
М – молярная масса – масса одного моля газа; единица измерения – кг/моль.
Для любой массы газа m уравнение Менделеева-Клапейрона можно переписать так:
PV= 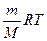 (8.7)
(8.7)
Полагая, что моль газа находится при нормальных условиях, можно найти значение молярной газовой постоянной (R = 8,31 Дж/моль К).
Часто уравнение Менделеева-Клапейрона (8.7) используют в иной форме записи. Для этого массу газа m и молярную массу выразим через число молекул и массу одной молекулы m = N×m0, M = Na×m0, где, Na = 6,02∙1023 моль-1 – число Авогадро[6]. Введем обозначение 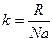 – постоянная Больцмана[7],
– постоянная Больцмана[7],
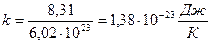
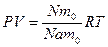 (8.8)
(8.8)
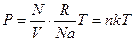 (8.9)
(8.9)
где n – концентрация молекул (число молекул в единице объема).
Выражение (8.9) также представляет собой уравнение Менделеева-Клапейрона.
Если смесь газа состоит из нескольких порций газов с концентрациями n1, n2, …. nn, то концентрация смеси n будет равна
n1+ n2+ … +nn (8.10)
Умножив (8.10) на kТ, получим закон Дальтона
Р = Р1 + Р2 +…. + Рn (8.11)
где, Р – давление смеси газа,
Р1, Р2,…. , Рn – парциальные давления газов, т.е. давления, создаваемые отдельными газами, входящими в состав смеси.
Закон Дальтона формулируется следующим образом:
Давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов.
Дата добавления: 2019-12-09; просмотров: 274;










