ДИАГРАММА СОСТОЯНИЯ двойных сплавов
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменяется состав сплава, его температура, давление, то изменяется и состояние сплава, что находит графическое отображение на диаграмме состояния.
Диаграмма состояния показывает устойчивые обладающие минимумом свободной энергии.
Диаграмма состояния показывает изменение состояния в зависимости от температуры (давление постоянно для всех рассматриваемых случаев) и концентрации.
Если система однокомпонентна, то диаграмма состояния будет иметь одно измерение (шкала температур) и соответствующие точки на оси покажут равновесную температуру изменения агрегатного состояния (рис. 86).
Если в системе два компонента, то диаграмму строят в двух измерениях (температура - концентрация) (рис. 87).
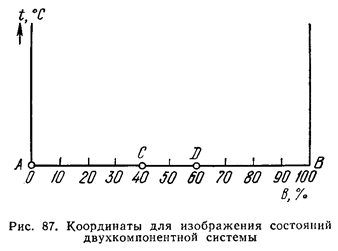
По оси ординат откладывают температуру, по оси абсцисс - концентрацию. Общее содержание обоих компонентов в сплаве равно 100%, и каждая точка на оси абсцисс соответствует определенному содержанию каждого компонента. В точке С 40% В и 60% А; в точке D 60% В и 40% А и т.д. По мере удаления от точки А увеличивается количество компонента В и в точке В его будет 100%. Следовательно, крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними - двойным сплавам.
Диаграмма состояния сплавов с тремя компонентами имеет пространственный вид (две оси концентрационные и одна температурная).
Экспериментальное построение диаграмм
Для построения диаграмм состояния пользуются результатами термического анализа, т.е. для ряда сплавов разных концентраций компонентов строят кривые охлаждения и по остановкам и перегибам на этих кривых, вызванным тепловым эффектом превращений, определяют температуры превращения.
Имея достаточное количество сплавов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния.
Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
Оба компонента в жидком состоянии неограниченно растворимы, а в твердом состоянии нерастворимы и не образуют химических соединений.
Компоненты: вещества А и В (k = 2).
Фазы: жидкость L, кристаллы А и кристаллы В (максимальное значение f=3).
Общий вид диаграммы состояния показан на рис. 92.
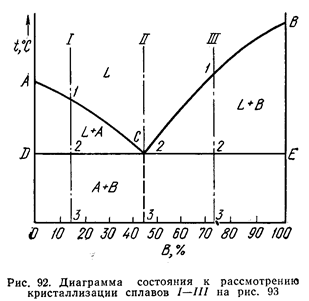
Линия АСВ является линией ликвидус, линия DСЕ - линией солидус. На линии АС начинают (при охлаждении) выделяться кристаллы А, а на линии СВ - кристаллы В. На линии DCE из жидкости концентрации С одновременно выделяются кристаллы А и В.
Если взять какой-нибудь сплав, например сплав 1, то кривая охлаждения для него будет иметь вид, показанный на рис. 93. На этой кривой участок 0 - 1 соответствует охлаждению жидкого сплава, участок 1 - 2 — выделению кристаллов А, участок 2 - 2' - совместному выделению кристаллов А и В и участок 2' – 3 - охлаждению твердого тела.
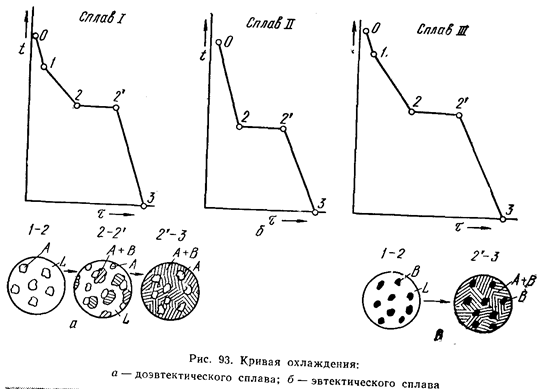
Механическая смесь двух (или более) видов кристаллов, одновременно кристаллизовавшихся из жидкости, называется эвтектикой.
Кривая охлаждения сплава эвтектической концентрации показана на рис. 93, б. На кривой охлаждения отрезок 0 - 2 соответствует охлаждению жидкого сплава, отрезок 2—2' - кристаллизации эвтектики и 2'—3 - охлаждению закристаллизовавшегося сплава.
Правило фаз
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов.
Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Следовательно, однородная жидкость является однофазной системой, а механическая смесь двух видов кристаллов - двухфазной, так как каждый кристалл одного вида отличается от кристалла другого вида по составу или по строению и они отделены поверхностью раздела.
Компонентами называются вещества, образующие систему. Следовательно, чистый металл представляет собой однокомпонентную систему, сплав двух металлов - двухкомпонентную и т.д. Химические соединения можно рассматривать как компоненты лишь в том случае, если они не диссоциируют на составные части в исследуемых интервалах температур.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе.
Если число степеней свободы равно нулю (нонвариантная система), то, очевидно, нельзя изменять внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызывало изменения числа фаз.
Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз.
Правило фаз представляет собой математическое выражение условия равновесия системы, т.е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы с и числом компонентов k и фаз f в условиях равновесия:
С = k - f+2
Независимыми переменными в уравнении правила фаз являются концентрация, температура и давление. Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу (давление постоянно), и уравнение правила фаз примет следующий вид:
С = k - f+1
Согласно правилу фаз, для двухкомпонентной системы (при постоянном давлении) при наличии двух фаз число степеней свободы равняется 1 (с = k—f+1=2 - 2+1=1), т.е. при каждой температуре концентрация фаз определенная.
4.2. Правило отрезков
В процессе кристаллизации изменяются и концентрация фаз (поэтому состав жидкости изменяется), и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда в сплаве одновременно существуют две фазы, можно определить количество обеих фаз и их концентрацию. Для этого служит так называемое правило отрезков.
Первое положение. Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз.
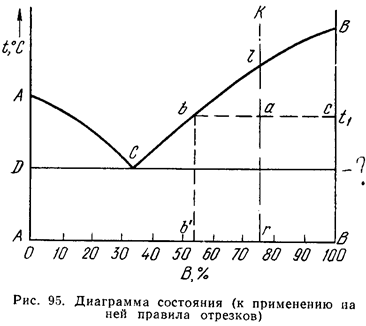
Следовательно, для сплава К при температуре t1 составы обеих фаз определятся проекциями точек b и с, так как эти точки находятся на пересечении горизонтальной линии, проходящей через точку а, с линиями диаграммы.
1. Сплав К содержит r% В и (100 – r)% А. В точке а сплав состоит из кристаллов В и жидкости концентрации b. Жидкость содержит bl % компонента В.
Второе положение. Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествамэтих фаз.
1. Масса кристаллов в т. а у сплава К соответствует х = ab/bc
2. Количество жидкости в т. а у сплава К соответствует 1 – х = ac/bc
3. Отношение количества твердой и жидкой фаз определяется соотношением:
х/1–х = ab/аc
Если точка а определяет состояние сплава, точка b - состав жидкой фазы, а точка с—состав твердой фазы, то отрезок bс определяет все количество сплава, отрезок ас — количество жидкости и отрезок bа — количество кристаллов.
Правило отрезков в двойных диаграммах состояния можно применить только в двухфазных областях. В однофазной области имеется лишь одна фаза; любая точка внутри области характеризует ее концентрацию.
Дата добавления: 2018-05-10; просмотров: 2743;











