Закономерности управления простым обратимым гомогенным процессом
Процессы массопередачи в гомогенных средах
Вполне очевидно, что в гомогенном процессе химической стадии тоже предшествует стадия диффузии, причем молекулы реагентов должны равномерно распределиться по всему объему реактора. В жидкофазных процессах диффузию интенсифицируют, используя различные способы перемешивания. Различают два вида смешения, обеспечивающие различную степень гомогенизации среды.
Состояние жидкости, при котором молекулы совершенно свободно перемещаются по объему реактора, называется несегрегированным. При таком перемешивании происходит равномерное распределение веществ по объему реактора; скорость перемешивания и другие гидродинамические факторы не оказывают влияния на скорость процесса.
В сегрегированном состоянии жидкость представляет собой совокупность большого числа глобул, каждая из которых содержит порядка 1012 молекул. Считают, что внешняя оболочка глобулы химически инертна, ее единственное назначение – сохранение глобулы. Сегрегированное состояние жидкости способствует возникновению локальных высоких концентраций реагентов, особенно в местах их подачи.
Реальные жидкофазные системы чаще всего являются сегрегированными. Сегрегация нарушает нормальное распределение реагентов и может влиять на селективность сложных реакций. Например,
А + В → С (целевой продукт)
С + B → D
Если молекула целевого продукта окажется в одной глобуле с молекулами реагента А, селективность будет высокая, если с молекулами реагента В – низкая.
Закономерности управления простым обратимым гомогенным процессом
Обратимыми называются процессы, в которых одновременно протекают прямая и обратная реакции.
Рассмотрим реакцию aA + bB ↔ cC + dD.
В начальный момент времени скорость прямой реакции, которая пропорциональна произведению концентраций реагентов А и В
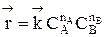 ,
,
больше скорости обратной реакции, пропорциональной произведению концентраций продуктов С и D
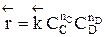 .
.
Но с течением времени, по мере увеличения концентрации веществ C и D скорость обратной реакции увеличивается, а скорость прямой реакции уменьшается. В некоторый момент времени они становятся равными 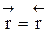 ; наступает химическое равновесие. После достижения равновесия соотношение участников реакции остается постоянным во времени. Это соотношение называется константой равновесия.
; наступает химическое равновесие. После достижения равновесия соотношение участников реакции остается постоянным во времени. Это соотношение называется константой равновесия.
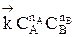 =
= 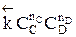
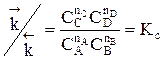
Для газофазных реакций константу равновесия можно выразить через парциальные давления участников реакции, которые пропорциональны их концентрации pi = Ci RT.
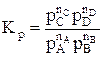
Между этими константами существует связь 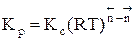 , где
, где 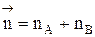 - суммарный порядок прямой реакции,
- суммарный порядок прямой реакции, 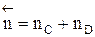 - суммарный порядок обратной реакции.
- суммарный порядок обратной реакции.
Константу равновесия газофазной реакции можно также выразить через мольные доли компонентов
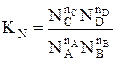 .
.
Парциальное давление каждого компонента пропорционально мольной доле его в смеси pi = p Ni, где р – общее давление системы, 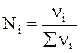 , νi – число молей данного компонента. Тогда
, νi – число молей данного компонента. Тогда 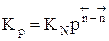 .
.
Константы Кс и Кр зависят только от температуры, а константа КN еще и от давления.
В случае реальных газовых смесей и растворов концентрации и парциальные давления в выражении констант меняют на активность «а» и фугитивность «f».
Итак, пределом протекания обратимых процессов является состояние равновесия, при котором скорости прямой и обратной реакции равны, а концентрации и парциальные давления продуктов и реагентов остаются постоянными во времени. При этом достигается некоторая максимальная в этих условиях степень превращения реагентов – равновесная конверсия α* и равновесный выход целевого продукта -β*. Их величина зависит от степени смещения равновесия в сторону образования целевого продукта. Следовательно, при управлении обратимым процессом важно не только обеспечить высокую скорость процесса, но и создать условия, при которых химическое равновесие смещено в сторону образования целевого продукта.
| <== предыдущая лекция | | | следующая лекция ==> |
| Кинетика процесса конвективной сушки. | | | Освоение скважин. Термины. Способы вызова притока из продуктивного пласта. |
Дата добавления: 2018-05-10; просмотров: 1106;











