РАЗДЕЛЕНИЕ БИОЛОГИЧЕСКИХ МОЛЕКУЛ МЕТОДОМ ГЕЛЬ-ФИЛЬТРАЦИИ
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которыми обладают многие пористые материалы.
Наиболее часто для этой цели применяют органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Разделение веществ при помощи гелей, основанное на различиях в размере молекул, называется гель-фильтрацией.
Гель-фильтрацию открыли в 1959 Д. Порат и П. Флодин, которые показали возможность фракционирования водорастворимых макромолекул, в т. ч. белков, по молекулярной массе, в качестве сита они использовали сшитый декстрановый гель. В 1964 Д. Мур предложил с помощью гель-проникающей хроматографии определять молекулярную массу полимеров, фракционируя их на стирол-дивинилбензольном геле.
В качестве молекулярного сита также применяются пористые стеклянные гранулы, а сам метод разделения получил название хроматографии фильтрованием через стекло с заданным размером пор. Понятие проникающая хроматография включает в себя все виды разделения молекул, основанные на принципе молекулярного сита.
Принцип, лежащий в основе метода проникающей хроматографии, прост. Хроматографическую колонку заполняют набухшим гелем или
пористыми стеклянными шариками и уравновешивают с помощью соответствующего растворителя. Крупные молекулы, не проникающие в поры сита, проходят между частицами геля, в то время как небольшие молекулы «застревают» в них и движутся с меньшей скоростью.
Для гель-фильтрации применяют гели на основе декстрана (сефадекс), полиакриламида (акрилекс, биогель Р), агарозы (сефароза, биогель А, сагавак), полиакрилоилморфина (энзокрилгель), полистиролов (Био-Бидз S).
Гель образует неподвижную фазу, в которой с током буфера происходит разделение биологических молекул. Гель формируют в колонках, чаще стеклянных, различного размера и диаметра (в зависимости от цели эксперимента). Гель-хроматография на сефадексе используется для обессоливания растворов белков (разделение крупных белковых молекул и малых молекул солей), определения молекулярных масс белков, разделения сложных смесей макромолекул. Размер биологических молекул является главным фактором их эффективного разделения при движении в пористом геле. Гели, используемые для хроматографии, имеют разный размер пор, что позволяет делить вещества в широком диапазоне молекулярных масс ( 1000 — 1000000 дальтон). При прохождении через колонку геля смеси молекул разного размера крупные молекулы движутся быстрее, чем мелкие, так как последние за счет проникновения в пористые гранулы геля проходят более длинный путь. В конечном итоге компоненты смеси элюируются с колонки, наполненной гранулами геля,в порядке уменьшения их молекулярной массы. Для характеристики процесса гель-фильтрации используют понятия: свободный объем колонки (Vo) и объем элюции (Ve). Свободный объем определяют путем пропускания через колонку раствора «голубого декстрана» (высокомолекулярного вещества с массой 2 х 106 дальтон). Объем, с которым выходит пиковая концентрация голубого декстрана, называется свободным объемом колонки (Vo). Объем, с которым выходит пиковая концентрация разделяемого вещества, называется объемом элюции (Ve).
В этом простейшем варианте хроматографии молекулы фракционируемых веществ не должны обладать никаким специальным сродством к неподвижной или подвижной фазам. Неподвижная фаза здесь представлена жидкостью, находящейся внутри пористых гранул,— точно такой же, как и жидкость подвижной фазы, протекающей между ними. Благодаря силам сцепления с поверхностью пространственной сетки полимера или иного пористого материала, образующего гранулы, жидкость внутри них остается неподвижной и не увлекается течением подвижной фазы. В подавляющем большинстве случаев применения гель-фильтрации для биологических целей рабочей жидкостью служат водно-солевые растворы, а материалы гранул гидрофильны. Переход молекул вещества из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен. Иная ситуация складывается внутри гранул. Здесь диффузия более или менее затруднена из-за столкновений молекул диффундирующего вещества с нитями пространственной сетки полимера или стенками пор. Если размеры молекул соизмеримы со средним диаметром каналов в гранулах, то эти затруднения становятся весьма существенными и диффузия тормозится.
Может сложиться и такое положение, когда часть внутреннего объема гранул, т. е. часть объема неподвижной фазы (а иногда и весь этот объем), оказывается недоступной для молекул вещества, растворенного в подвижной фазе.
Различие степени доступности объема неподвижной фазы для молекул различных компонентов исходной смеси веществ является фактором, определяющим возможность их фракционирования. Очевидно, что оно будет происходить по размерам молекул (рис. 1). Если в составе смеси имеются очень крупные молекулы, вовсе не проникающие внутрь гранул, то они будут выходить из колонки или достигать края хроматографической пластины вместе с передним фронтом подвижной фазы («фронтом элюции»). В то же время мелкие молекулы, свободно диффундирующие внутрь гранул, часть времени будут находиться в неподвижной фазе. Статистически эта часть времени одинакова для всех молекул такого размера и зависит от соотношения объемов жидкости в неподвижной и подвижной фазах. Таким образом, все мелкие молекулы достигнут конца хроматографического пути более или менее одновременно и заведомо позднее, чем крупные. Молекулы промежуточных размеров, для которых из-за разброса значений эффективных диаметров пор внутри гранул неподвижной фазы доступна только часть ее объема, должны, очевидно, перемещаться вдоль колонки или пластины с промежуточной скоростью.
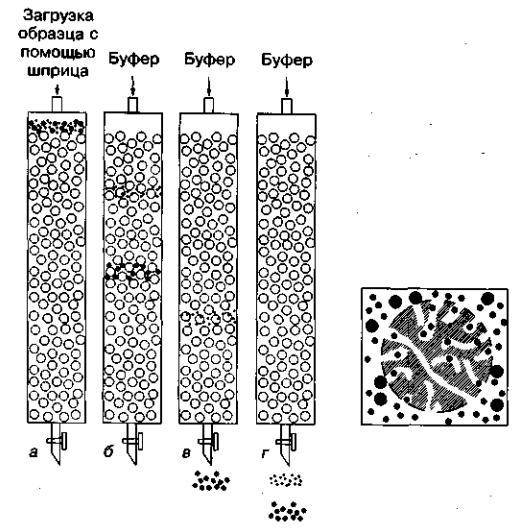
Рис. 1. Гель-фильтрационная хроматография. Малые молекулы в образце могут проникать внутрь гранул, вследствие этого они протекают через колонку медленнее. Крупные молекулы, которые не могут проникнуть в гранулы через поры, проходят сквозь колонку быстрее, чем более мелкие. Правильный размер пор и свойства растворителя являются решающими для хорошего разделения.
Это явление первоначально было названо «гель-фильтрацией», поскольку в качестве пространственной сетки использовали полимерные гели. Однако эти гели относительно легко деформируются и для хроматографии при высоком давлении непригодны, поэтому их стали заменять жесткими материалами, в частности пористым стеклом и силикагелем. Иногда для этого варианта хроматографии вводят термин «эксклюзивная хроматография» («exclusion» — исключение; имеется в виду исключение из гранул крупных молекул). Поскольку сейчас силикагель явно вытесняет пористое стекло, мы сохраним для рассматриваемого варианта хроматографии прежнее название — гель-фильтрация.
Очевидно, что размеры молекул связаны с их массами, но отнюдь не целиком ими определяются. Это особенно важно учитывать в случае макромолекул, размеры которых могут существенно зависеть от плотности упаковки полипептидной или полинуклеотидной цепи. В ограничении свободы диффузии через пространственную сетку пор внутри гранул немалую роль может играть и форма молекулы. Очевидно, что сферическая глобула будет диффундировать иначе, чем молекула такого же объема, но вытянутая в виде палочки.
Как во всех хроматографических разделениях излишняя длина колонки приводит к размыванию пика (Рис. 2).
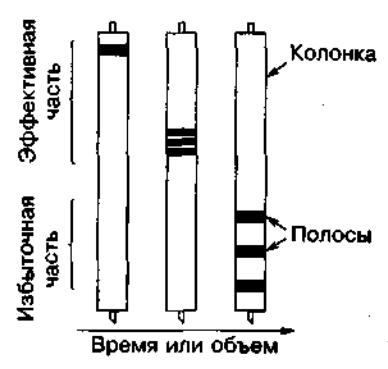
Рис. 2. Уширение полос в колонке из-за чрезмерной длины колонки. Так называемая эффективная часть колонки является достаточной для разделения. Слишком длинные колонки не улучшают очистку, но вызывают разбавление образца из-за уширения полос.
Гель-фильтрационная хроматография является методом для оценки молекулярной массы молекул. Гель-фильтрация также оказывается полезной для измерения равновесий мономер-мультимер при микромолярных (мкМ) концентрациях биомолекул (Рис. 3).
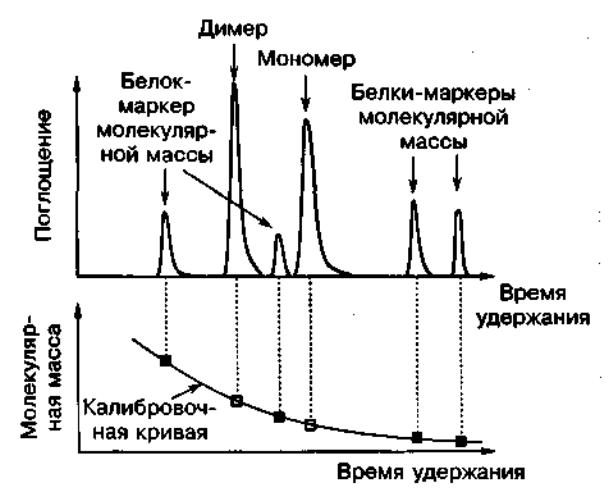
Рис.3. Молекулы с известной молекулярной массой дают возможность оценить молекулярную массу неизвестной молекулы. В данном случае для исследуемой молекулы наблюдаются два пика, что указывает на равновесие мономер-димер.
Пористые материалы для гель-фильтрации чаще всего выпускаются в виде сферических гранул целого набора диаметров с различными средними размерами пор.
Гели на основе декстрана (сефадексы)
Декстран также представляет собой полисахарид — в основном линейный полимер на основе глюкозы, где звенья связаны β-1,6-глюкозидной связью
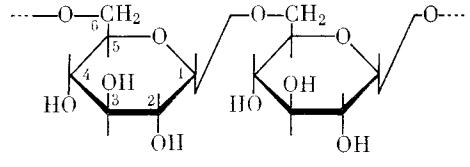 Рис.2. Химическая форма декстрана.
Рис.2. Химическая форма декстрана.
Это тоже полиатомный спирт с высокой степенью гидрофильности, предоставляющий столь же широкие, как и целлюлоза, возможности для модификации и также химически инертный. Устойчивость к действию кислот у декстрана еще меньше, чем у целлюлозы. Его не следует обрабатывать более крепким раствором, чем 0,1 н. НС1 (в течение 2 ч). К щелочи гели на основе декстрана более устойчивы: они сохраняют свои свойства в 0,25 н. NaOH до 2 мес даже при температуре 60оС. Рабочий диапазон рН составляет 2-12. Существенное отличие от целлюлозы состоит в том, что нити декстрина не образуют агрегатов, так как они не вполне линейны — имеются достаточно многочисленные ветвления (по связям 1.2-, 1,3- и 1,4-).
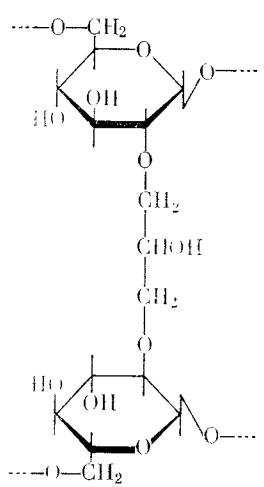 Химическая форма сефадекса.
Химическая форма сефадекса.
В гелях для хроматографии («сефадексах») нити декстрана химически сшиты эпихлоргидрином. Однако сшивка не очень жесткая: сефадексы относительно мягки и легко сжимаются, а в водных растворах сильно набухают. Утери качества выражены тем сильнее, чем меньше процентное содержание эпихлоргидрина. Изменяя долю сшивки, можно регулировать средний размер пор, образуемых пространственной сеткой сшитого геля. Ввиду статистического распределения сшивок по объему геля разброс размеров пор невелик, и сефадексы заметно более гомогенны, а свойства их лучше воспроизводимы, чем у целлюлозы.
Они «не боятся» высушивания и при замачивании не требуют никакой специальной обработки. Сефадексы можно автоклавировать как в сухом, так и во влажном виде в нейтральной среде при 120оС в течение 30 мин. Суспензию сефадекса (набитую колонку) следует хранить с антисептиком, так как он, подобно целлюлозэ, легко атакуется микроорганизмами. Сефадексам присуща некоторая адсорбционная способность по отношению к ароматическим и гетероциклическим молекулам, которую даже удается использовать для фракционирования нуклеиновых оснований,ароматических аминокислот и пептидов. Кроме того, продажные сефадексы содержат в своей структуре небольшое количество карбоксильных групп, что придает им некоторое сродство к катионам. При хроматографии его легко подавить введением в элюент соли (NaCl) в концентрации около 0,02 М.
Мягкость сефадексов (особенно слабосшитых) накладывает ограничения на допустимые значения скоростей хроматографическон элюцпи, которые подробно рассмотрены ниже. По этой же причине определенные сложности возникают при использовании ионообмеиников па основе сефадексов: за счет сил электростатического отталкивания своих ионогенных групп они склонны деформироваться при изменении ионной силы элюента. Все это привело к разработке в последние годы ряда более жестких матриц, вытесняющих сефадексы из традиционных областей их применения — гель-фильтрации и ионообменной хроматографии.
Агароза
Как и предыдущие матрицы, агароза является полисахаридом, т. е. полиатомным спиртом. Ее элементарным звеном служит дисахарид агаробиоза. в состав которого входит необычный сахар - 3.6-ангидро-L-галактоза. Из-за этого агароза более устойчива к действию микроорганизмов, чем целлюлоза и сефадексы, однако ее тоже следует хранить в присутствии антисептика. Агароза очень гидрофильна, а ее полимерные нити еще в большей степени, чем нити целлюлозы, склонны к образованию водородных связей. Благодаря этому горячий 2-6%-ньтй раствор агарозы застывает в виде жесткого и очень крупнопористого геля. Нити полимера собираются в пучки и образуют жесткий пространственный каркас с пустотами внутри. При температуре около 100°С гель агарозы плавится, поэтому его нельзя автоклавировать: в случае необходимости гель приходится стерилизовать раствором диэтилпирокарбоната. Модификация агарозы может происходить также по гидроксильным группам, плотность расположения которых, однако, значительно ниже, чем у сефадексов, поскольку на звено дисахарида их приходится четыре вместо шести.
Положение усугубляется тем, что внутри плотно упакованных пучков нитей гидроксильные группы недоступны для модификации. В условиях хроматографии агароза химически неактивна, но уязвима для действия кислот, щелочей и окислителей. Рабочий диапазон рН при использовании матриц из обычной агарозы лежит в пределах 4-9. Агароза выдерживает непродолжительный контакт с 8 М мочевиной и 6 М гуанидиихлоридом, которые все же постепенно ее разрушают.Поскольку агароза для хроматографии представляет собой водный гель, о набухании ее говорить не приходится. Но следует помнить о том, что агарозу нельзя сушить ввиду необратимой деструкции геля. Агароза для хроматографии поставляется в виде суспендированных в воде сферических гранул диаметром 60— 200 мкм, которые в таком виде и следует хранить. При кратковременном обсыхании колонки, заполненной агарозой, пока гранулы не начали терять находящуюся в них жидкость, хроматографнческне характеристики сорбента еще могут быть восстановлены. Если же подсыхание гранул началось, то гель приходится выбрасывать (разумеется, его можно расплавить и использовать, например, для электрофореза, но гранулированная структура будет уже утрачена). Размер пор (пустот) в гранулах зависит от процентного содержания агарозьг в геле (2, 4 или 6%). Связанные с агарозой остатки сульфокислоты (до 0,5% по массе) могут сорбировать щелочные белки. Эта сорбция подавляется в присутствии 0,02 М NaCl или другой соли. Гранулированную агарозу для гель-фильтрации и синтеза аффинных сорбентов выпускают следующие фирмы: «Pharmacia» — под торговым названием «Sepharose», «Bio-Rad» — под названием «Bio-Gel A», «LKB» (Швеция) и «IBF» (Франция) — под названием «Ultrogel А».
Для повышения химической и термической стойкости матриц фирма «Pharmacia» разработала вариант гелей агарозы, в которых нити полимера дополнительно химически «сшиты» обработкой 2,3-дибромпропанолом в сильно щелочной среде. Матрицы на основе такой «сшитой» агарозы носят общее наименование «Sepharose CL». Их можно использовать в значительно более широком диапазоне рН (3—14) и даже автоклавировать при температуре 120оС. Они обладают еще большей жесткостью, выдерживают длительный контакт с 8 М мочевиной и 6 М гуанидинхлоридом, а также со многими органическими растворителями (этанолом, ацетоном, хлороформом, пиридином, ацетонитрилом, дихлорэтаном, ДМФ, ДМСО и др.). Последнее обстоятельство имеет важное значение для осуществления реакций модификации.
В настоящее время агароза широко применяется как в колоночной хроматографии в виде модифицированных сорбентов состоящих из сферических гранул строго определенного размера (Q-Sepharose, SP-Sepharose, Phenyl-Sepharose и т.д.), так и в виде гелей, в основном применяемых для электрофоретического разделения нуклеиновых кислот при молекулярно-биологических и биотехнологических исследованиях.
Дата добавления: 2018-05-10; просмотров: 1756;











