Структурно-механические свойства дисперсных систем
К структурно-механическим свойствам относят вязкость, упругость, пластичность, прочность. Структурно-механические свойства исследует наука реология.
В разбавленных золях при больших расстояниях между коллоидными частицами взаимодействием между ними можно пренебречь. Такие системы называют свободнодисперсными (бесструктурными).
При увеличении концентрации дисперсной фазы между частицами возникают контакты, при этом за счет ванн-дер-ваальсовых сил образуются структуры. К структуированным коллоидным системам относятся обладающие малой прочностью гели, в которых частицы дисперсной фазы разделены прослойками среды. При определенных условиях гели могут превращаться в золи и, наоборот, при длительном хранении гидрофильные золи переходят в особое «студнеобразное» коллоидное состояние. В таком виде их называют гелями. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняется среда, например, вода. Гель можно высушить, превратив его в твердый коллоид. Примером гидрофильного золя может служить золь желатина. При набухании твердого желатина в воде образуется гель. При нагревании геля («студня») образуется золь. Все процессы обратимы:
Золь D Гель D Твердый коллоид
Заключение
Коллоидные растворы имеют большое значение в нашей жизни и находят очень широкое применение в технике, медицине и сельском хозяйстве. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость. Почва, природные воды, лекарственные вещества, пищевые продукты, парфюмерные товары, средства борьбы с сельскохозяйственными вредителями и сорняками находятся в коллоидном состоянии. Исключительная важность этих систем для жизни человечества определяет необходимость их изучения.
Контрольные вопросы
1. Опишите растворы как гомогенные системы.
2. Дайте определения способам выражения состава растворов (массовая доля, молярная и молярная концентрация эквивалентов).
3. Охарактеризуйте свойства разбавленных молекулярных растворов (понижение давления пара растворителя, повышение температуры кипения, понижение температуры замерзания, осмотическое давление).
4. Охарактеризуйте растворы электролитов, их отличия от молекулярных растворов.
5. Приведите основные положения теории электролитической диссоциации С. Аррениуса и сольватной теории Д.И. Менделеева.
6. Дайте определение степени диссоциации электролитов. Как подразделяют электролиты по степени диссоциации? Приведите примеры ступенчатой диссоциации многоосновных кислот и многокислотных оснований.
7. Охарактеризуйте диссоциацию слабых электролитов как обратимый процесс. Приведите вывод уравнения закона разбавления Оствальда.
8. Объясните, почему константа диссоциации сильных электролитов изменяется с изменением концентрации.
9. Чем определяется направленность реакций в растворах электролитов? Приведите формулировку правила Бертолле.
10. Охарактеризуйте воду как слабый электролит константой диссоциации. Что такое водородный показатель? Как он характеризует кислотность раствора?
11. Дайте определение произведению растворимости (ПР), как показателю, характеризующему равновесие между осадком малорастворимого вещества и насыщенным раствором.
12. Что такое дисперсная система, дисперсная фаза и дисперсионная среда? Приведите классификацию дисперсных систем по агрегатному состоянию фаз. Приведите примеры дисперсных систем.
13. Дайте определение и приведите примеры лиофобных и лиофильных дисперсных систем.
14. На примере рассмотрения границы раздела фаз жидкость – газ объясните, что такое свободная поверхностная энергия и поверхностное натяжение.
15. Опишите поверхностные явления – адсорбцию и десорбцию. Дайте определения понятиям – адсорбент, адсорбат, адсорбтив.
16. Опишите строение коллоидной частицы на примере AgCl, полученной при избытке AgNO3.
17. Объясните механизм возникновения и строение двойного электрического слоя на поверхности коллоидных частиц.
18. Опишите методы получения коллоидных растворов.
19. Объясните что такое коагуляция и седиментация коллоидных растворов, как их вызвать и как предотвратить.
20. Опишите оптические и кинетические свойства коллоидных растворов.
Примеры выполнения заданий
Пример 1а. Определите массу кристаллогидрата CuSO4×5H2O, необходимого для приготовления 50 г 10%-ного раствора сульфата меди. Какой объем воды необходим для приготовления этого раствора?
| Дано: | Решение: |
| mр-ра = 50 г | Найдем массу безводной соли в 50 г 10%-ного р-ра: |
| ω(CuSO4) = 10% | 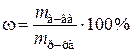
|
| m(CuSO4) = 50× 0,1 = 5 (г) | |
| Найти: V(H2O) m(CuSO4×5H2O) | M(CuSO4) = 64 + 32 + 4×16 = 160 г/моль Найдем количество вещества CuSO4: v = m/M, v(CuSO4) = 5/160 = 0,031 моль |
Найдем массу кристаллогидрата, содержащего 5 г безводной соли:
1 моль CuSO4×5H2O содержит 1 моль CuSO4,
v(CuSO4×5H2O) = v(CuSO4) = 0,031 моль.
M(CuSO4×5H2O) = 160 + 5×18 = 250 г/моль,
m(CuSO4×5H2O) = 250×0,031 = 7,8 г.
Найдем объем воды, необходимый для приготовления раствора:
m(H2O) = mр-ра – mв-ва,
m(H2O) = 50 – 7,8 = 42,2 г
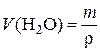 , r(Н2О) = 1 г/мл,
, r(Н2О) = 1 г/мл,
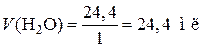
Ответ: m(CuSO4 5H2O) = 7,8 г;
V(H2O) = 42,2 мл.
Пример 1б. Приведите расчет для приготовления 200 мл 0,3 н. раствора сульфата никеля из имеющегося в лаборатории NiSO4×7H2O и воды.
| Дано: | Решение: |
| СН(NiSO4) = 0,3 моль-экв/л | 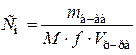
|
| Vр-ра = 200мл = 0,2 л | |
| Найти: m(NiSO4×7H2O). |
Найдем массу соли NiSO4×7H2O. Так как 1 моль кристаллогидрата содержит 1 моль безводной соли, то при приготовлении растворов заданной нормальной или молярной концентрации, расчет ведут по молярной массе кристаллогидрата.
mв-ва = Cн×M×f×Vр-ра,
М = 59 + 32 + 64 + 18×7 = 281 г/моль, f = 1/2,
mв-ва = 0,3 × 281 × 0,5 × 0,2 = 8,43 г.
Растворы молярной и нормальной концентрации готовят в мерных колбах заданного объема, поэтому объем добавляемой воды не рассчитывают.
Ответ: m(NiSO4×7H2O) = 8,43 г.
Пример 1в. Какой объем 15%-ного раствора карбоната натрия (r = 1,10 г/мл) необходим для приготовления 120 мл 0,45 М раствора?
| Дано: | Решение: |
| ω(Na2CO3) = 15% | 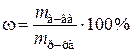 , , 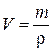 , ,
|
| r(15%р-ра) = 1,1 г/мл | 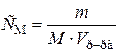 (приложение 1) (приложение 1)
|
| V(0,45Мр-ра) = 120 мл | М(Na2CO3) = 2×23 + 12 + 3×16 = 106 г/моль |
| СМ = 0,45 моль/л | Масса безводного Na2CO3 в 120 мл 0,45 М р-ра: |
| Найти: V15%р-ра | m(Na2CO3) = 0,45×106×0,12 = 5,72 г |
Найдем, в какой массе 15%-ного раствора содержится 5,72 г карбоната натрия:
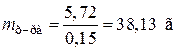 ,
,
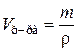 ,
,
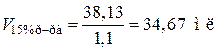
Ответ: V15%р-ра = 34,67 мл.
Пример 1г. Какая масса соли необходима для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,3.
| Дано: | Решение: |
| СН(AlCl3) = 0,3 моль-экв/л Vр-ра=200мл=0,2 л | 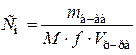 ,
Найдем массу соли: mв-ва = Cн×M×f×Vр-ра,
М(AlCl3) = 27 + 3 × 35,5 = 133,5 (г/моль);
f(AlCl3) = 1/3
m(AlCl3) = 0,3 × 133,5 × 0,2 × 1/3 = 26,7 (г) ,
Найдем массу соли: mв-ва = Cн×M×f×Vр-ра,
М(AlCl3) = 27 + 3 × 35,5 = 133,5 (г/моль);
f(AlCl3) = 1/3
m(AlCl3) = 0,3 × 133,5 × 0,2 × 1/3 = 26,7 (г)
|
| Найти: m(AlCl3). |
Ответ: m(AlCl3) = 26,7 г.
Пример 2. Составьте выражения констант диссоциации для угольной и сернистой кислот. Пользуясь таблицей 7, определите, какая из них является более слабым электролитом. Рассчитайте степень диссоциации сернистой кислоты в 0,001 М растворе.
H2CO3 D H+ + HCO3– 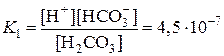
HCO3– D H+ + CO32– 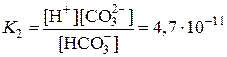
Kобщ = K1×K2 = 4,5×10–7×4,7×10–11 = 2,1×10–17
H2SO3 D H+ + HSO3– 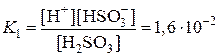
HSO3– D H+ + SO32– 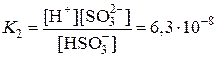
Kобщ = K1×K2 = 1×10–9
Из сравнения значений констант диссоциации угольной и сернистой кислот видно, что угольная кислота более слабая (K(H2CO3) < K(H2SO3)).
| Дано: K(H2SO3)=1×10–9 CM = 0,001моль/л = 10–3 моль/л | Решение:
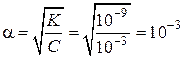
|
| Найти: α(H2SO3) | Ответ: α = 10–3. |
Пример 3. Составьте выражения ПР гидроксидов магния и железа(II), пользуясь таблицей 6, сравните их растворимость.
В насыщенных водных растворах труднорастворимых веществ устанавливаются гетерогенные равновесия между осадком и ионами электролита в растворе:
Mg(OH)2(к) D Mg2+ + 2OH– ПР(Mg(OH)2) = [Mg2+][OH–]2 = 2,3×10–13
Fe(OH)2(к) D Fe2+ + 2OH– ПР(Fe(OH)2)= [Fe2+][OH–]2 = 7,9×10–16
ПР(Mg(OH)2) > ПР(Fe(OH)2) .
Растворимость гидроксида магния больше растворимости гидроксида железа (II).
Пример 4. Произведение растворимости AgIO3 равно 3,2×10–8 при 25°C. Рассчитайте молярную концентрацию AgIO3 в его насыщенном при данной температуре растворе.
| Дано: ПР(AgIO3)=3,2×10–8 | Решение: AgIO3(к) D Ag+ + IO3– |
| Найти: СМ | Находим молярную концентрацию AgIO3 в его насыщенном растворе над осадком: ПР=[Ag+][IO3–],
СМ(AgIO3) = [Ag+] = [IO3–] = 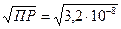 = 1,79×10–4 (моль/л) = 1,79×10–4 (моль/л)
|
Ответ: СМ = 1,79×10–4 моль/л.
Пример 5. Рассчитайте концентрацию ОН–-ионов, а также рН и рОН раствора, укажите реакцию среды, если [H+] = 8,32×10–4 моль/л.
| Дано: | Решение. |
| [H+] = 8,32×10–4 моль/л | pH= –lg[H+] pH = –lg8,32×10–4 = –(lg8,32 + lg10–4) = –(0,92 –4) = 3,08; pH < 7 |
| Найти: [OH–], pH, pOH, указать среду. | Kв = [H+][OH–] = 10–14;
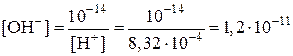 (моль/л) (моль/л)
|
рОН = –lg[OH–];
pOH = –lg1,2×10–11 = –(lg1,2 + lg10–11) = –(0,08 – 11) = 10,92
Проверка: рН + рОН = 14; 3,08 + 10,92 = 14
Ответ: [OH–] = 1,2×10–11 моль/л; рОН = 10,92; рН = 3,08; среда кислая.
Пример 6. Какие из указанных солей подвергаются гидролизу: нитрат лития, сульфат хрома (III), ортофосфат натрия, сульфид хрома (III)? Приведите ионные и молекулярные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия.
Гидролизу подвергаются те растворимые соли, которые образованы слабым основанием (гидролиз по катиону) или слабой кислотой (гидролиз по аниону), т.к. лишь взаимодействие их ионов приводит к образованию слабого электролита (связыванию ионов) и смещению ионного равновесия диссоциации воды.
Алгоритм составления уравнений обратимого гидролиза:
1. Составьте краткое ионное уравнение взаимодействия одного иона слабого электролита с одной молекулой воды. Укажите рН раствора соли (> или < 7), а также влияние подкисления или подщелачивания среды на смещение равновесия гидролиза (в соответствии с принципом Ле-Шателье).
2. Составьте полное ионное уравнение, приписав к левой и правой частям уравнения формулы ионов сильного электролита, не участвующих в гидролизе.
3. Составьте молекулярное уравнение гидролиза соли по первой ступени, при необходимости расставьте коэффициенты.
4. Если гидролиз идет по трехзарядному иону, составьте уравнения гидролиза по второй ступени, повторив действия 1-3 и приняв за исходную соль продукт первой ступени. Учтите, что число стадий гидролиза по многозарядному иону, реально протекающих при обычных условиях, как правило, на одну меньше, чем заряд иона, т.к. каждая последующая стадия привела бы к образованию более сильного электролита.
Решение.
LiNO3 – соль образована сильным основанием (LiOH) и сильной кислотой (HNO3), гидролизу не подвергается, т.к. ионы Li+ и NO3– не образуют с водой слабых электролитов, рН = 7.
Cr2(SO4)3 – соль образована слабым основанием (Cr(OH)3), и сильной кислотой (H2SO4), гидролиз по катиону.
I ступень Cr3+ + HOH D CrOH2+ + H+ pH < 7
Cr3+ + SO42- + HOH D [CrOH]2+ + H+ + SO42–
Cr2(SO4)3 + 2HOH D 2[CrOH]SO4 + H2SO4
II ступень [CrOH]2+ + HOH D [Cr(OH)2]+ + H+
[CrOH]2+ + SO42– + HOH D [Cr(OH)2]+ + H+ + SO42–
2[CrOH]SO4 + 2HOH D [Cr(OH)2]2SO4 + H2SO4
По третьей ступени гидролиз практически не идет, т.к. это привело бы к образованию более сильного электролита Cr(OH)3, чем Cr(OH)2+.
Усилить гидролиз можно связыванием протонов в воду, т.е. добавлением щелочи, а также нагреванием и разбавлением раствора. К смещению равновесия гидролиза влево приведет добавление кислоты.
Na3PO4 – соль образована сильным основанием (NaOH) и кислотой средней силы (H3PO4), гидроанионы которой являются слабыми электролитами (гидролиз по аниону).
I ступень PO43– + HOH D HPO42– + OH– pH > 7
PO43– + Na+ + HOH D HPO42– + Na+ + OH–
Na3PO4 + HOH D Na2HPO4 + NaOH
II ступень HPO42– + HOH D H2PO4– + OH–
Na+ + HPO42– + HOH D H2PO4– + Na+ + OH–
NaHPO4 + HOH D NaH2PO4 + NaOH
Усиление гидролиза возможно при добавлении кислоты, нагревании, разбавлении. Подщелачивание среды приведет к смещению равновесия влево.
По третьей ступени гидролиз при обычных условиях практически не идет, т.к. H3PO4 более сильный электролит, чем H2PO4–.
Cr2S3 – соль образована слабым многокислотным нерастворимым основанием Cr(OH)3 и слабой многоосновной летучей кислотой – H2S. Такие соли подвергаются полному необратимому гидролизу. При этом сразу образуются конечные продукты гидролиза – осадок слабого основания и летучая кислота.
Cr2S3 + 6H2O = 2Cr(OH)3¯ + 3H2S pH » 7.
Пример7а. Определить давление пара раствора при 40°С, содержащего 3,6 г глюкозы в 250 г воды. Давление пара воды при той же температуре равно 55,32 мм рт. ст.
| Дано: | Решение: |
| m1(глюкозы) = 3,6 г | По закону Рауля: 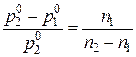 , или , или 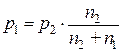 .
Найдем число молей С6Н12О6 (n1) и Н2О (n2):
n = m/M
M(С6Н12О6) = 180 г/моль,
n1 = 3,6:180 = 0,02 моль
М(Н2О) = 18 г/моль, n2 = 250:18 = 13,89 моль
р1 = 55,32×13,89/(13,89+0,02) = 55,24 мм рт. ст. .
Найдем число молей С6Н12О6 (n1) и Н2О (n2):
n = m/M
M(С6Н12О6) = 180 г/моль,
n1 = 3,6:180 = 0,02 моль
М(Н2О) = 18 г/моль, n2 = 250:18 = 13,89 моль
р1 = 55,32×13,89/(13,89+0,02) = 55,24 мм рт. ст.
|
| m2(H2O) = 250 г | |
| р2 = 55,32 мм рт. ст. | |
| Найти: р1 |
Ответ: р1 = 55,24 мм рт. ст.
Пример 7б. Определить температуру замерзания раствора, содержащего 0,8132 г нафталина в 25,46 г бензола. Температура замерзания бензола 5,5°С, а криоскопическая постоянная его 5,12.
| Дано: m1(C10H8) = 0,8132 г m2(С6Н6) = 25,46 г tЗ = 5,5°С EЗ = 5,12 | Решение:
DТз = ЕзСm;
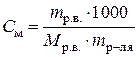 , , 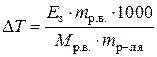 М(С10Н8) = 128 г/моль,
DТз = 5,12×0,8132×1000/25,46×128 = 1,277°
DТз = tз – t(з.ра-ра), t(з. ра-ра) = tЗ – DТз,
t(з.ра-ра) = 5,5 – 1,277 = 4,223°С
Ответ: раствор замерзает при 4,223°С.
М(С10Н8) = 128 г/моль,
DТз = 5,12×0,8132×1000/25,46×128 = 1,277°
DТз = tз – t(з.ра-ра), t(з. ра-ра) = tЗ – DТз,
t(з.ра-ра) = 5,5 – 1,277 = 4,223°С
Ответ: раствор замерзает при 4,223°С.
|
| Найти: tзамерз. раствора. |
Пример7в. Определить массовую долю мочевины в водном растворе, если его температура кипения 100,174°С. Эбуллиоскопическая постоянная воды 0,512.
| Дано: tк. р-ра = 100,174°С Ек = 0,512 | Решение:
DТк = ЕкСm, 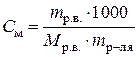 , , 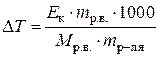 для 100 г раствора mр-ля = (100 – mр.в.);
М(CO(NH2)2) = 60 г/моль
для 100 г раствора mр-ля = (100 – mр.в.);
М(CO(NH2)2) = 60 г/моль
|
| Найти: w%р.в. | DТк = 100,174 – 100 = 0,174°
Из уравнения 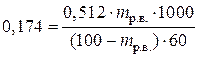 находим mр.в..
mр.в. = 2 г. Т.е. в 100 г раствора – 2 г мочевины или 2%.
Ответ: раствор содержит 2% мочевины находим mр.в..
mр.в. = 2 г. Т.е. в 100 г раствора – 2 г мочевины или 2%.
Ответ: раствор содержит 2% мочевины
|
Задания для самостоятельного решения
Задание 1. Решите расчетную задачу.
1. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
2. Какая масса KCl потребуется для приготовления 250 мл 0,15 М раствора?
3. Найдите массу NaNO3, необходимую для приготовления 150 мл 2 М раствора.
4. В каком объеме 0,1 н CuSO4 содержится 8 г безводной соли?
5. В каком объеме 0,3 М раствора NaCl содержится 2 г соли?
6. Определите молярную концентрацию раствора, содержащего 11,2 г КОН в 200 мл раствора.
7. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
8. Определите молярную концентрацию раствора Na2SO4, содержащего 42 г соли в 300 мл раствора.
9. Вычислите молярную концентрацию Ва(ОН)2 в растворе, если в 2 л его содержится 2 г щелочи.
10. Сколько г NaBr потребуется для приготовления 700 мл 0,15 н раствора соли?
11. Какая масса KCl потребуется для приготовления 250 мл 1,15 М раствора соли?
12. Найдите массу NaOH, необходимую для приготовления 2 л 0,3 н раствора.
13. В каком объеме 2 М раствора NaCl содержится 5 г соли?
14. Какова концентрация раствора, содержащего 9 г CaCl2 в 500 мл раствора?
15.В каком объеме 0,1 н раствора CuCl2 содержится 5 г соли?
Задание 2. Составьте уравнения диссоциации соединений, формулы которых приведены ниже. В тех случаях, где это необходимо, приведите уравнения ступенчатой диссоциации. Составьте выражения констант диссоциации предложенных кислот. Какая из двух является более слабой? Рассчитайте степень диссоциации одной из кислот в 0,01 М растворе.
| Вариант. | ||||||||
| Кислоты | HClO H3BO3 | HNO2 H2Se | H2S HIO | H3BO3 HBrO | HСlO2 H2CO3 | H2SO3 HClO | HBrO H2CO3 | HIO H3PO4 |
| Вариант | ||||||||
| Кислоты | H2CO3 HCN | H2SO3 HNO2 | H2S COOH | H3BO3 HNO2 | H3PO4 HСlO2 | HClO H2S | H2Se СН3СООН |
Задание 3. Составьте выражения ПР указанных веществ, сравните их растворимость. Рассчитайте концентрацию катионов и анионов в насыщенном растворе одного из этих веществ.
| Вариант | ||||||||
| Вещества | AgBr AgCl | Mg(OH)2 MgS | CaSO4 BaSO4 | AgI AgCl | FeS CuS | SrSO4 BaSO4 | CdS CuS | AgBr AgI |
| Вариант | ||||||||
| Вещества | CaCO3 CaSO4 | HgS CuS | FeS Fe(OH)2 | CuI AgI | CuCl CuI | Cu(OH)2 CuS | Zn(OH)2 ZnS |
Задание 4. Рассчитайте концентрацию ионов ОН-, а также рН раствора, укажите реакцию среды, если концентрация ионов Н+ составляет:
| Варинт | [H+], моль/л | Вариант | [H+], моль/л | Вариант | [H+], моль/л |
| 3,82×10–12 | 9,12×10–5 | 7,55×10–7 | |||
| 2,85×10–2 | 6,38×10–10 | 4,52×10–4 | |||
| 2,88×10–6 | 8,85×10–11 | 3,33×10–3 | |||
| 5,28×10–13 | 8,32×10–6 | 1,86×10–11 | |||
| 7,56×10–1 | 6,25×10–9 | 8,84×10–12 |
Задание 5. Приведите молекулярные и ионные уравнения тех реакций, которые возможны в растворе, объясните их направленность.
| Вариант | Схемы реакций | Вариант | Схемы реакций |
| Cu(OH)2 + Na2SO4® Na2SO4 + BaCl2 ® Fe(OH)3 + H2SO4 ® Al(OH)3 + NaOH ® Pb(NO3)2 + H2S ® | NaOH + CaCO3® CaSO4 + SrCl2 ® [CuOH]2SO4 + HCl ® Cu(NO3)2 + H2S ® CuCl2 + AgNO3 ® | ||
| H2CO3 + Ca(NO3)2 ® NaCl + LiNO3 ® Cr(OH)3 + KOH ® Na2CO3 + HCl ® Ca(HCO3)2 + Ca(OH)2 ® | KCl + H2SO4 ® [NiOH]2SO4 + HCl ® Pb(NO3)2 + Cu(OH)2 ® Na2CO3 + Ca(NO3)2 ® NH4NO3 + NaOH ® | ||
| CaCO3 + LiCl ® K2S + HCl ® Mg(OH)2 + Na2SO4 ® [FeOH]2SO4 + H2SO4 ® Pb(OH)2 + HNO3 ® | Pb(OH)2 + KOH ® H2S + FeCl2 ® ZnSO4 + Cu(OH)2 ® NaH2PO4 + NaOH ® CaCl2 + Na2CO3 ® | ||
| Cu(NO3)2 + BaSO4 ® Ba(OH)2 + H2SO4 ® CuSO4 + KCl ® Be(OH)2 + KOH ® Ba(HCO3)2 + NaOH ® | HNO3 + K2SO4 ® Al(OH)3 + KOH ® KOH + Na2SO4 ® CaCO3 + H2O + CO2 ® BaS + CuSO4 ® | ||
| Be(OH)2 + KOH ® FeOHCl2 + HCl ® Na2SO4 + K2CO3 ® NaNO3 + Zn(OH)2 ® CaCl2 + H2SO4 ® | Na2SiO3 + HCl ® Cr(OH)3 + HNO3 ® CuCl2 + KNO3 ® CrOHSO4 + H2SO4 ® AgNO3 + CuCl2 ® | ||
| Ba(NO3)2 + Na2SO4 ® CuOHCl + NaOH ® KNO3 + Na2CO3 ® Al(OH)3 + KCl ® Na2CO3 + H2SO4® | CaS + HCl ® CoCl2 + KOH ® Pb(NO3)2 + KCl ® Be(OH)2 + Ba(OH)2 ® NaNO3 + H2SO4 ® | ||
| BaCl2 + H2SO4 ® Na3PO4 + H2S ® NaOH + AlCl3 ® PbOHNO3 + HNO3 ® Na2S + KCl ® | K2SO4 + H2SO3 ® BaS + CuSO4 ® Al(OH)3 + NaCl ® SrSO4 + CaCl2 ® Cr(OH)3 + NaOH ® | ||
| Be(OH)2 + KOH ® AgNO3 + CaCl2 ® HNO3 + CaS ® KBr + Zn(OH)2 ® NaHSO4 + NaOH ® |
Задание 6. Составьте молекулярные уравнения реакций, соответствующие следующим кратким ионным.
| Вар. | Краткое ионное уравнение | Вар. | Краткое ионное уравнение |
| H2PO4– + OH- = HPO42– + H2O Pb2+ + SO42– = PbSO4¯ [Cr(OH)2]+ + 2H+ = Cr3+ + 2H2O | 3Ag+ + PO43– = Ag3PO4¯ HCO3– + OH- = CO32– + H2O BaCO3 + 2H+ = Ba2+ + CO2 + H2O | ||
| [Fe(OH)2]+ + 2H+ = Fe3+ + 2H2O H2S + 2Ag+ = Ag2S¯ + 2H+ CO32– + 2H+ = CO2 + H2O | HAsO42– + OH- = AsO43– + H2O [AlOH]2+ + H+ = Al3+ + H2O 2H+ + S2– = H2S | ||
| HCO3– + H+ = H2O + CO2 Ni(OH)2 + 2H+ = Ni2+ + 2H2O CO32– + Ca2+ = CaCO3¯ | FeOH2+ + 2OH- = Fe(OH)3¯ MgCO3 + 2H+ = Mg2+ + CO2 + H2O Cu2+ + S2– = CuS¯ | ||
| SO32– + 2H+ = SO2 + H2O [CuOH]+ + H+ = Cu2+ + H2O 3Ca2+ + 2PO43– = Ca3(PO4)2¯ | H2S + Pb2+ = PbS¯ + 2H+ BaSO3 + 2H+ = Ba2+ + SO2 + H2O [Fe(OH)2]+ + OH– = Fe(OH)3¯ | ||
| H2PO4– + 2OH– = PO43– + 2H2O Pb2+ + 2I– = PbI2¯ CaCO3 + 2H+ = Ca2+ + CO2 + H2O | Pb2+ + 2Br– =PbBr2¯ HS- + OH– = S2– + H2O BaSeO3 + 2H+ = Ba2+ + SeO2 + H2O | ||
| HSO3– + OH- = SO32– + H2O Ag+ + I– = AgI¯ Co(OH)2 + 2H+ = Co2+ + 2H2O | [FeOH]+ + OH– = Fe(OH)2¯ Sr2+ + SO42+ = SrSO4¯ SO32– + 2H+ = H2O + SO2 | ||
| 3Ba2+ + 2PO43- = Ba3(PO4)2¯ HSe– + H+ = H2Se Ag+ + Br– = AgBr¯ | [CuOH]+ + H+ = Cu2+ + H2O H2S + 2Ag+ = Ag2S¯ + 2H+ H2AsO4– + 2OH– = 2H2O + AsO43– | ||
| Hg2+ + S2– = HgS¯, [Al(OH)2]+ + 2H+ = Al3+ + 2H2O, H+ + OH– = H2O |
Задание 7. Рассчитайте концентрацию ионов Н+ и ОН- в растворе, рН которого равен:
| Вариант | ||||||||
| рН | 4,3 | 10,8 | 2,6 | 12,5 | 8,3 | 11,6 | 1,8 | 6,7 |
| Вариант | ||||||||
| рН | 9,4 | 3,8 | 9,3 | 2,3 | 13,2 | 5,6 | 1,1 |
Задание 8. Какие, из указанных солей подвергаются гидролизу? Приведите молекулярные и ионные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия гидролиза.
| Вариант | Названия солей |
| Фосфат калия, сульфат меди (II), хлорид рубидия, сульфид алюминия | |
| Ацетат аммония, нитрат хрома (III), карбонат лития, сульфат цезия | |
| Нитрат натрия, сульфид бария, хлорид железа (III), сульфид железа (III) | |
| Хлорид бария, сульфид натрия, сульфат меди (II), карбонат хрома (III) | |
| Сульфит калия, нитрат кобальта (II), нитрат калия, сульфид хрома (III) | |
| Иодид лития, сульфит натрия, нитрат алюминия, карбонат аммония | |
| Ацетат натрия, сульфат железа (II), карбонат алюминия, бромид калия | |
| Нитрат свинца (II), нитрит аммония, сульфат калия, карбонат натрия | |
| Хлорид цинка, нитрат бария, сульфид алюминия, ацетат меди (II) | |
| Нитрит кальция, нитрат никеля (II), карбонат железа (III), хлорид рубидия | |
| Бромид калия, сульфид натрия, хлорид меди (II), сульфид хрома (III) | |
| Нитрат меди (II), сульфид кальция, нитрат стронция, сульфид аммония | |
| Хлорид меди (II), фосфат цезия, сульфат калия, сульфид железа (II) | |
| Нитрат натрия, хлорид бериллия, фосфат калия, сульфит аммония | |
| Сульфат алюминия, нитрит бария, хлорид калия, сульфид алюминия |
Задание 9. Приведите молекулярные и краткие ионно-молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их протекания:
| Вар | Превращения | Вар | Превращения |
| BaCO3 ® Ba(HCO3)2 ® BaCO3 Fe2O3 ® Fe(OH)3 Cu ® CuSO4 Cu(NO3)2 ® CuOHNO3 ® Cu(NO3)2 Na2SO4 ® NaCl | ZnO ® Zn(OH)2 Ca3(PO4)2 ® CaHPO4 ® Ca3(PO4)2 FeCl3 ® FeOHCl2 ® FeCl3 KNO3 ® HNO3 Fe ® FeCl2 | ||
| Hg ® Hg(NO3)2 ZnSO4 ® (ZnOH)2SO4 ® ZnSO4 Na3PO4 ® NaCl K2SO3 ® KHSO3 ® K2SO3 MgO ® Mg(OH)2 | KCl ® KNO3 Cu ® CuCl2 PbO ® Pb(OH)2 MgCO3 ® Mg(HCO3)2 ® MgCO3 AlCl3 ® Al(OH)2Cl ® AlCl3 | ||
| Fe ® Fe(NO3)2 CuSO4 ® CuCl2 Al2O3 ® Al(OH)3 FeCl2 ® FeOHCl ® FeCl2 K3PO4 ® KH2PO4 ® K3PO4 | K2S ® KHS ® K2S CuO ® Cu(OH)2 Cr2(SO4)3 ® CrOHSO4 ® Cr2(SO4)3 KCl ® HCl Al ® Al2(SO4)3 | ||
| Cr(NO3)3 ® CrOH(NO3)2 ® Cr(NO3)3 SnO ® Sn(OH)2 K2CO3 ® KHCO3 ® K2CO3 K3PO4 ® KNO3 Cu ® Cu(NO3)2 | Fe ® FeCl3 Ba3(PO4)2 ® Ba(H2PO4)2 ® Ba3(PO4)2 FeO ® Fe(OH)2 AlCl3 ® AlOHCl2 ® AlCl3 K2SO4 ® KCl | ||
| MnO ® Mn(OH)2 Al2(SO4)3 ® [Al(OH)2]2SO4 ® Al2(SO4)3 BaCl2 ® Ba(NO3)2 CaCO3 ® Ca(HCO3)2 ® CaCO3 Mg ® Mg(NO3)2 | ZnCl2 ® ZnOHCl ® ZnCl2 Na2SO3 ® NaHSO3 ® Na2SO3 Cr2O3 ® Cr(OH)3 CuSO4 ® Cu(NO3)2 Fe ® FeSO4 | ||
| Na3PO4 ® NaH2PO4 ® Na3PO4 NiO ® Ni(OH)2 Al(NO3)3 ® Al(OH)2NO3 ® Al(NO3)3 Ag ® AgNO3 NaNO3 ® Na2SO4 | CoO ® Co(OH)2 Al2(SO4)3 ® [Al(OH)2]2SO4 ® Al2(SO4)3 KCl ® K2SO4 Al ® AlCl3 Na2CO3 ® NaHCO3 ® Na2CO3 | ||
| CrCl3 ® Cr(OH)2Cl ® CrCl3 BeO ® Be(OH)2 Na2SO4 ® NaNO3 Zn ® Zn(NO3)2 Mg3(PO4)2 ® Mg(H2PO4)2 ® Mg3(PO4)2 | Na2S ® NaHS ® Na2S Fe2O3 ® Fe(OH)3 Pb(NO3)2 ® PbOHNO3 ® Pb(NO3)2 KNO3 ® K2SO4 Al ® Al2(SO4)3 | ||
| PbO ® Pb(OH)2, K3PO4 ® KCl, Pb ® Pb(NO3)2 CaSO3 ® Ca(HSO3)2 ® CaSO3, Fe2(SO4)3 ® FeOHSO4 ® Fe2(SO4)3 |
Задание 10. Решите расчетную задачу.
1. Раствор 7,252 г глюкозы в 200 г воды замерзает при –0,378°С. Криоскопическая постоянная воды равна 1,86. Определите молекулярную массу глюкозы.
2. Давление пара воды при 80°С равно 355,1 мм рт.ст. Рассчитайте давление пара над раствором, содержащим 6 г мочевины СО(NH2)2 в 180 г воды.
3. При какой температуре замерзнет раствор 0,022 моль глюкозы в 100 г воды? Криоскопическая постоянная воды равна 1,86.
4. Определите относительное понижение давления пара над раствором, содержащим 4,14 г салициловой кислоты С7Н6О3 в 100 г этилового спирта.
5. Определите температуру замерзания раствора 0,625 граммов мочевины CO(NH2)2 в 50 г воды. Криоскопическая постоянная воды 1,86.
6. Давление пара бензола (С6Н6) при 20°С равно 75,18 мм рт.ст. Вычислите, давление пара над раствором, содержащим 0,514 г дифениламина (C6H5)2NH в 50 г бензола при этой температуре.
7. Определите температуру замерзания раствора, содержащего 1,205·1023 молекул неэлектролита в 1 л воды. Криоскопическая постоянная воды 1,86.
8. Какова массовая доля фруктозы С6Н12О6 в водном растворе, который замерзает при –0,524°С? Криоскопическая постоянная воды 1,86.
9. Давление пара воды при 50°С равно 92, 5 мм рт.ст. Сколько моль глюкозы надо растворить в 270 г воды, чтобы давление пара над раствором понизилось на 0,5 мм рт.ст.?
10. Вычислите давление пара воды над 5%-ным водным раствора глицерина C3H8O3 при 25°С. Давление пара воды при этой температуре равно 23,76 мм. рт. ст.
11. Определите температуру замерзания раствора 0,8 граммов мочевины CO(NH2)2 в 80 г воды. Криоскопическая постоянная воды 1,86.
12. Вычислите температуру кипения водного однопроцентного раствора глицерина С3Н8О3. Эбуллиоскопическая постоянная воды 0,512.
13. Вычислите молекулярную массу бензальдегида, если раствор 1,612°г его в 100 г эфира С4Н10О кипит при 34,806°С. Температура кипения эфира 34,5°С, а эбуллиоскопическая постоянная его равна 2.
14. Давление пара раствора, содержащего 0,425 г анилина в 100 г эфира (С4Н10О) при 20°С равно 440,9 мм рт.ст. Давление пара над чистым эфиром при той же температуре – 442,4 мм рт. ст. Определите молекулярную массу анилина.
15. Давление пара бензола (С6Н6) при 20°С равно 75,18 мм рт.ст. Вычислите, давление пара над раствором, содержащим 0,4 г анилина С6Н7N в 50 г бензола при этой температуре.
Тестовые задания для самоконтроля
1. Количество молей вещества в единице объема раствора –
1) молярная концентрация;
2) нормальная концентрация;
3) массовая доля.
2. Отношение массы растворенного вещества к массе раствора –
1) массовая доля;
2) нормальная концентрация;
3) молярная концентрация.
3. Растворимость газа пропорциональна его парциальному давлению над раствором –
1) Закон Генри;
2) Закон Рауля;
3) Закон Вант-Гоффа.
4. К сильным электролитам относится?
1) H2S;
2) H2O;
3) HCl.
5. В растворе не возможна реакция:
1) Be(OH)2 + 2KOH = K2[Be(OH)4];
2) KOH + HNO3 = KNO3 + H2O;
3) KOH + NaNO3 = KNO3 + NaOH.
6. Отрицательный логарифм концентрации ионов водорода в растворе:
1) Kнестойкости;
2) ПР;
3) рН.
7. Автором гидратной теории растворов является:
1) С. Аррениус;
2) Д.И. Менделеев;
3) Н.К. Курнаков.
8. Электролиты, при диссоциации которых в качестве анионов образуются только ОН–- ионы, – это:
1) кислоты;
2) основания;
3) соли.
9. Ступенчатой диссоциации в растворе подвергаются молекулы…
1) Na2SO4;
2) HBr;
3) H2SO3.
8. Уравнение Kд = α2с является выражением закона:
1) Рауля;
2) Вант-Гоффа;
3) Оствальда.
11. Дисперсной системой является:
1) раствор сахара;
2) минеральная вода;
3) молоко.
12. Согласно теории строения коллоидных растворов, мицелла является _______ частицей:
1) электронейтральной;
2) отрицательно заряженной;
3) положительно заряженной.
13. Движение частиц дисперсной фазы к одному из электродов называется:
1) электрофорезом;
2) электроосмосом;
3) коагуляцией.
14. Процесс укрупнения частиц, приводящий к потере устойчивости золя, называется:
1) седиментацией;
2) коагуляцией;
3) электрофорезом.
15. Рассеяние света частицами дисперсной фазы коллоидного раствора, являющееся следствием коллоидной степени дисперсности этих частиц, открыл:
1) Броун;
2) Тиндаль;
3) Рейсс.
Ответы к тестовым заданиям
| № вопроса | |||||||||||||||
| № ответа |
Лабораторная работа № 6
Часть I. Сильные и слабые электролиты
Цели работы: изучить электрическую проводимость растворов электролитов и влияние на нее различных факторов.
Реактивы: 1 н. растворы соляной кислоты, уксусной кислоты, гидроксида натрия и гидроксида аммония.
Оборудование:источник питания посто
Дата добавления: 2017-11-21; просмотров: 2576;











