Квантово-механическая модель атома водорода. Квантовые числа
Вывод о квантовании энергии электрона в атоме водорода получается в
квантовой механике без привлечения постулатов Бора как решение
уравнения Шредингера.
Рассмотрим движение электрона в кулоновском поле ядра, заряд которого 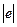 .
.

При этом электрон обладает потенциальной энергией где r1- первый боровский радиус. Состояние электрона описывается некоторой волновой функцией, удовлетворяющей уравнению Шредингера:
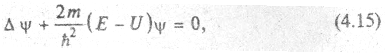
где Е - полная энергия электрона в атоме.
Учитывая, что кулоновское поле ядра, определяющее энергию электрона, центрально-симметрично, целесообразно решать уравнение Шредингера в сферических координатах r, θ, φ.
При этом функция ψ(х, у, z) переходит в функцию ψ(r, θ, φ), а последняя распадается на три функции R(r), θ(0), Ф(φ).
На искомую волновую функцию наложены естественные условия:
- в каждой точке пространства волновая функция характеризуется единственным значением;
- значение ψ - функции нигде не обращается в бесконечность;
- ψ - функция есть непрерывная функция координат.
Казалось, что при этих условиях решение уравнения Шредингера возможно лишь при целых значениях некоторых параметров, от которых зависят функции R, θ, Ф. Опуская математические выкладки, рассмотрим результаты решения уравнения (4.15) и их физический смысл.
Решение относительно полной энергии электрона Е, связанного в атоме, дает дискретный набор значений

где n = 1,2, 3, … .
Таким образом, так же, как и в случае частицы в потенциальной ямс, электрон в атоме находится в дискретных энергетических состояниях (рис. 4.11). Уровень Е1 является основным, остальные - возбужденными. При Е < 0 электрон связан в атом при Е > 0 - свободен; в этой области значения энергии изменяются непрерывно. Для отрыва электрона (ионизация атома) надо сообщить электрону извне энергию Е1..
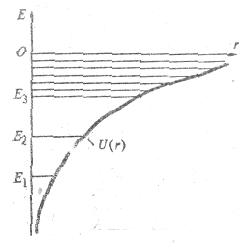 |
Рис. 4.11.
Число n называется главным квантовым числом.
Из решения уравнения (4.15) следует, что момент импульса электрона в атоме также квантуется по формуле
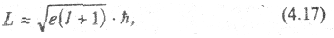
где число l =0, 1, 2, …, n - 1 - называется орбитальным квантовым числом.
Проекция момента импульса электрона на некоторое направление z также квантуется:

где число m = -l, -l +1, l -1, l называется магнитным квантовым числом.
Определение расстояния ri электрона от ядра, соответствующего основному состоянию (n = 1), дает значение

совпадающее с первым боровским радиусом.
Было установлено также, что микрообъект (в том числе электрон) обладает специфической характеристикой, называемой спином. Спин можно интерпретировать как своеобразный момент импульса микрообъекта, не связанный с его движением, не зависящий от внешних условий, неуничтожимый. Квадрат этого момента импульса (не путать с L) равен 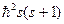 , где число s и называется спином. Спин может принимать только целые и полуцелые значения (для электронов, например, s=±1/2). Проекция спинового момента на некоторое направление z принимает значение nσ, где σ=-s, -+1, ..., s-1, s — спиновое квантовое число.
, где число s и называется спином. Спин может принимать только целые и полуцелые значения (для электронов, например, s=±1/2). Проекция спинового момента на некоторое направление z принимает значение nσ, где σ=-s, -+1, ..., s-1, s — спиновое квантовое число.
Таким образом, набор квантовых чисел n, l, m, σ , где l, m, σ зависят от значения п, определяется состояние атома. Общее число возможных стационарных состояний N = 2n2.
Дата добавления: 2017-11-21; просмотров: 1245;











