Лекция № 10. Свойства паров
Цель: объяснить явления испарения, конденсации, кипения и выяснить условия, от которых зависят эти процессы; ввести понятие «насыщенный пар»; объяснить понятие «влажность воздуха», показать практическое применение и важность данной физической величины.
Основные понятия:
Парообразование – явление перехода вещества в пар называется.
Испарение и кипение – формы парообразования.
Конденсация – явление перехода пара в жидкое состояние.
Динамическое равновесие пара и жидкости – состояние, при котором за одно и то же время испаряется и конденсируется одинаковое число молекул пара.
Насыщенный пар – пар, находящийся в динамическом равновесии с жидкостью.
Абсолютная и относительная влажность воздуха – физические величины, показывающие количество водяных паров в воздухе.
Точка росы – это температура, при которой пар, находящийся в воздухе, становится насыщенным.
Испарение.
Молекулы газов и жидкостей хотя и малы по размерам, но имеют конечные размеры и определенную форму и между ними существуют довольно значительные силы взаимодействия. В этом состоит главное отличие реальных газов и жидкостей от идеальных, как упрощенной модели реальных объектов.
При изучении идеальных газов отмечалось, что многие его свойства не зависят от природы газа. Однако чем ниже температура и больше давление, тем заметнее зависимость свойств газа от его природы. Газ в таких условиях называют паром, тем самым указывая, что он образовался из определенной жидкости.
Явление перехода вещества в пар называется парообразованием. В природе парообразование происходит в виде испарения и кипения.
Парообразование с открытой поверхности жидкости называется испарением.
Испаряются не только жидкости, но и твердые тела. Испарение твердых тел называется сублимацией.
Рассмотрим процесс испарения жидкостей. Так же как диффузия, испарение происходит вследствие непрерывного хаотического движения молекул жидкости. Всякая молекула, движущаяся из глубины жидкости к ее поверхности, испытывает в поверхностном слое действие силы, препятствующей вырыванию молекулы с поверхности жидкости. Чтобы пройти сквозь поверхностный слой, молекула должна обладать достаточной кинетической энергией для совершения работы выхода с поверхности жидкости. Скорости молекул жидкости, как и молекул газа, различны. Жидкость покидают наиболее «быстрые» молекулы, вследствие чего средняя кинетическая энергия оставшихся молекул уменьшается, что ведет к понижению температуры жидкости. Для поддержания постоянной температуры жидкости ей необходимо сообщать энергию извне, например, в виде теплоты. Количество теплоты Q, необходимое для превращения в пар 1 кг жидкости при постоянной температуре, называется удельной теплотой парообразования:
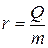 .
.
В СИ удельная теплота парообразования выражается в джоулях на килограмм (Дж/кг).
После того как молекула жидкости переместилась от границы поверхностного слоя на расстояние, большее радиуса действия молекулярных сил жидкости, она становится молекулой пара. Молекулярные силы действуют на сравнительно коротких расстояниях (порядка 10 нм).
Конденсация.
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называют конденсацией. При конденсации пара некоторой массы выделяется столько энергии, сколько затрачивается при испарении жидкости такой же массы. Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
Если жидкость находится в открытом сосуде, то молекул испаряется больше, чем конденсируется, и масса жидкости уменьшается.
Следует обратить внимание, что процесс парообразования связан с увеличением внутренней энергии вещества, а процесс конденсации – с уменьшением ее.
Следовательно, конденсация и парообразование происходят только в процессе обмена энергией между окружающей средой и веществом.
Дата добавления: 2021-09-25; просмотров: 968;











