Принимает цифровые и буквенные значения: 1, 2, 3, 4, 5, 6, 7; или K, L, M, N, O, P, Q .
ОСНОВНЫЕ ХИМИЧЕСКИЕ ЗАКОНЫ.
1.Закон сохранения массы веществ (независимо друг от друга открыт в 1748г. М.В.Ломоносовым и в 1789 г. А.Лавуазье): масса исходных веществ равна массе продуктов реакции.
Поэтому для соблюдения этого закона каждая химическая реакция должна быть уравнена (одинаковое число атомов каждого элемента в левой и правой частях уравнения гарантирует одинаковые массы всех веществ).
2.Закон постоянства состава: всякое чистое вещество независимо от способов его получения имеет постоянный качественный и количественный состав.
Пример :
Вещество «углекислый газ» может быть получено различными способами:
а) С + О2 = СО2;
б) СаСО3 = СаО + СО2;
в) СН4 + 2О2 = СО2 + 2 Н2О;
но во всех случаях состав молекулы один и тот же: 1 атом углерода и 2 атома кислорода.
3.Закон Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Следствия:
- При нормальных условиях (н.у.) 1 моль любого газа занимает объем
22,4 л (н.у.: Р = 1 атм = 760 мм рт.ст. = 101325 Па; t = 0о С; Т = 273 К).
- Относительная плотность одного газа по другому равна отношению их молярных (М) или относительных молекулярных (Мr) масс.
4.Уравнение Менделеева-Клапейрона – уравнение состояния идеального газа:
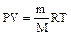 ,
,
где Р – давление газа, Па; V – его объем, м3; m – масса вещества, г;
М – молярная масса вещества, г/моль; Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль* К).
Вопросы для закрепления материала:
1.Определить степени окисления элементов в соединении NH4 MnO4.
2.Рассчитать плотность NO по: а)водороду; б)воздуху; в)кислороду; г)азоту.
СТРОЕНИЕ АТОМА
Слово «атомос», что означает «неделимый», ввел в своих трудах Демокрит примерно 2400 лет тому назад.
В 18-19 веках М.В.Ломоносов, А.Лавуазье, Д.Дальтон, А.Авогадро, С.Канницаро, Д.И.Менделеев занимались теорией строения атома и в результате этих исследований установили связь между понятиями “атом” и “элемент”. Появились представления о размерах и массе атомов.
Конец 19 и начало 20 века отмечены такими фундаментальными открытиями, как обнаружение радиоактивности (А.Беккерель,1896 г.), рентгеновского излучения (В.Рентген, 1895 г.), открытие фотоэффекта (А.Энштейн, 1887 г.), открытие электрона (Дж. Томсон, 1897 г.), возникновение идеи квантования энергии атома (М. Планк, 1900), установление линейчатого характера спектров атомов. Эти открытия вызывали необходимость в создании теории строения атома.
В 1911 г. Э.Резерфорд на основе эксперимента создает ядерную (планетарную) модель строения атома:
1) в центре атома находится положительно заряженное ядро, очень малое по размерам, в котором сосредоточена почти вся масса атома (радиус атома /радиус ядра = 10-8см /10-13см = 105 );
2) вокруг ядра на значительном расстоянии вращаются отрицательно заряженные электроны;
3) так как атом электронейтрален, то суммарный заряд электронов равен заряду ядра.
Дальнейшие исследования показали, что число электронов и заряд ядра соответствует порядковому номеру элемента.
В 1924 г. Луи де Бройль высказал предположение, что любым микрочастицам, в том числе и электронам, присуща двойственная корпускулярно-волновая природа, причем длина волны
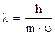
где h – постоянная Планка;
m – масса микрочастицы;
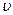 - её скорость.
- её скорость.
В 1926 г. Э. Шрёдингер вывел математическое описание электронной структуры атома, т.н. “волновое уравнение”, которое связывает волновую функцию 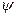 с потенциальной энергией электрона U и его полной энергией Е:
с потенциальной энергией электрона U и его полной энергией Е:
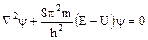 ,
,
где 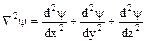 – сумма вторых производных волновой функции
– сумма вторых производных волновой функции 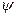 по координатам X,Y, Z; m - масса электрона, h – постоянная Планка. Суть
по координатам X,Y, Z; m - масса электрона, h – постоянная Планка. Суть 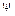 такова, что
такова, что 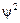 есть плотность вероятности нахождения электрона в той или иной точке относительно ядра. При решении волнового уравнения возникает квантование энергии в сферической системе координат. Из этого уравнения следует, что электрон в атоме образует стоячую волну, которая определяет устойчивый характер движения электрона.
есть плотность вероятности нахождения электрона в той или иной точке относительно ядра. При решении волнового уравнения возникает квантование энергии в сферической системе координат. Из этого уравнения следует, что электрон в атоме образует стоячую волну, которая определяет устойчивый характер движения электрона.
1927г. К. Д. Дэвиссон и Л. Х. Джермер экспериментально подтвердили волновую природу электрона: пучок электронов давал дифракционный и интерференционный эффекты ( при этом длина волны соответствовала формуле Луи де Бройля).
1927г. В. Гейзенберг установил принцип неопределенности: невозможно одновременно определить положение частицы и ее импульс или какое-либо связанное с импульсом свойство (например скорость, энергию и др.).
К этому времени самое простое из ядер – ядро атома водорода – было названо элементарной частицей «протоном» (p). Исследования Г.Мозли привели к выводу, что число протонов в ядре атома того или иного элемента равно номеру этого элемента в Периодической системе элементов.
В 1932 г. после открытия еще одной элементарной частицы «нейтрона» (n) группой физиков из различных стран была создана теория строения ядра из протонов и нейтронов. Силы, удерживающие эти частицы в ядре, называются «ядерные», их природу изучает ядерная физика.
Свойства элементарных частиц, образующих атом
Общее название протонов и нейтронов – «нуклоны».
При подсчете массы атома пренебрегают массой электронов и тогда молярная масса атома = массе ядра = сумме протонов и нейтронов. Так как сумма протонов = порядковому номеру элемента, то тогда общее число нейтронов можно найти по разнице между молярной массой элемента и порядковым номером.
Таблица 1
Свойства наиболее важных элементарных частиц
| Свойство | Частица | |||
| Ядро | Электрон | a-частица (ядро гелия) | ||
| Протон | Нейтрон | |||
| Масса (а.е.м.) | 1,0073 | 1,0087 | 0,00055 | |
| Заряд (усл. ед.) | +1 | -1 | +2 | |
| Заряд (Кл) | 1,6×10-19 | -1,6×10-19 | 3,2×10-19 |
Пример :
Определить состав ядра у лития:
а) порядковый номер = 3, т.е. сумма протонов = 3;
б) сумма нейтронов = MLi - порядковый номер: 7 - 3 = 4.
Изотопы: а) разновидности атомов, имеющих одинаковый заряд ядра, но различную массу;
б) атомы одного и того же элемента, имеющие одинаковое число протонов, но различное число нейтронов в ядре.
Изотопы бывают:
Стабильные (их примерно 300). Не имеют стабильных изотопов элементы с порядковыми №№ 43, 61, 84 - 107.
Нестабильные, радиоактивные (их примерно 1700). Характеризуются «периодом полураспада»: время, за которое первоначальная масса какого-либо изотопа уменьшается в 2 раза за счет радиоактивных превращений.
Пример 1: Даже самый легкий элемент «водород» имеет несколько изотопов:
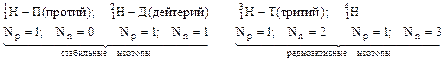
Пример 2:
Атомные массы элементов считают из массовых чисел всех изотопов, взятых в процентном соотношении в соответствии с нахождением в природе. Так, элемент «хлор» представлен в природе двумя изотопами: с массой 35 а.е.м.- 75% и с массой 37 а.е.м. – 25%. Для вычисления средней массы возьмем 100 атомов хлора и найдем их суммарную массу: вес более легких атомов = 35*75; вес более тяжелых атомов =37*25, отсюда
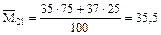 (а.е.м.) или 35,5 г/моль.
(а.е.м.) или 35,5 г/моль.
Ядерные реакции-превращения атомных ядер в результате их взаимодействия с элементарными частицами, или друг с другом, или самопроизвольно. При этом соблюдаются законы сохранения массы и заряда.
Первую ядерную реакцию осуществил Э.Резерфорд в 1919 г.:
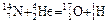 ,
,
краткая запись реакции: 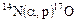 .
.
Изобары – атомы, имеющие одинаковые массовые числа, но различные заряды ядер.
Пример: К изобарам можно отнести 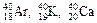 .
.
Строение электронных оболочек атома
В 1913 г. датчанин Н. Бор формулирует постулаты:
1) Электрон может двигаться вокруг ядра не по любым орбиталям, а по строго определенным («разрешенным»).
2) При движении электрона по устойчивой орбитали его запас энергии сохраняется постоянным; при переходе электрона с удаленной от ядра орбитали на более близкую он теряет энергию, а переход на более удаленную от ядра орбиталь требует дополнительной энергии.
3) При электронных переходах энергия выделяется и поглощается не непрерывно, а порциями («квантами»).
Сложность поведения электрона заключается в его противоречивой природе:
а) с одной стороны электрон – это частица, т.к. имеет массу, заряд;
б) в то же время для электрона характерны волновые свойства (дифракция, дисперсия, интерференция).
Эту двойственность учитывает квантовая механика, которая предлагает следующие определения:
Электронное облако – квантово-механическая модель, описывающая состояние электрона в атоме (или пространство вокруг ядра, в котором может находиться электрон).
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона ( в орбитали ~ 90% электронного облака ).
Изучение атомных орбиталей, рассчитанных с помощью уравнения Шредингера, показало, что характер движения электрона в атоме определяется четырьмя числами: n, l, m, s, получившими название квантовых.
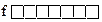
Главное квантовое число n.Показывает удаленность электрона от ядра, т. к. соответствует номеру электронного слоя. (В квантовой механике говорят, что это число характеризует энергию электронов, занимающих определенный энергетический уровень).
Принимает цифровые и буквенные значения: 1, 2, 3, 4, 5, 6, 7; или K, L, M, N, O, P, Q .
Максимальное число электронов находят по формуле 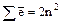 .
.
Примеры :
1) 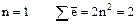 (т.е. на первом слое находится число
(т.е. на первом слое находится число 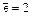 );
);
2) 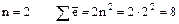 (на втором слое может быть
(на втором слое может быть 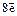 );
);
3) 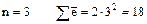 (на третьем слое -
(на третьем слое - 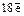 ).
).
Орбитальное (азимутальное) квантовое число l. Характеризует форму электронного облака. Принимает цифровые и буквенные значения (см. табл. 2).
Таблица 2
Цифровые и буквенные значения орбитального квантового числа
| l | n | |||
| Цифровые значения | 0, 1 | 0, 1, 2 | 0, 1, 2, 3 | |
| Буквенные значения | s | s, p | s, p, d | s, p, d, f |
| Форма орбитали | «сфера» | «гантель» | «четырёх-лепестковая» | «шести-лепестковая» |
Буквенные значения орбитального числа совпадают с названием энергетического подуровня.
Цифровые значения находят по формуле: lmax = n – 1. Анализ табл.2 показывает, что на каждом новом электронном слое имеются орбитали уже известной формы и появляются новые орбитали. Размер атомных орбиталей разной формы возрастает с увеличением n.
Магнитное квантовое число m. Указывает на ориентацию облаков в пространстве. Для каждого конкретного l принимает ряд целых значений.
m: -l, …-2, -1, 0, +1, +2, …+l, т.е. всего (2l + 1) значений – это число говорит о количестве одинаковых орбиталей в подуровне. Из этого следует, что m = 2l + 1.
Примеры:
1) n = 1, l = 0 (s-облако) – сколько их на каждом слое?
m = 2×0 + 1 = 1 – т.е. s-орбиталь всегда одна.
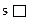 .
.
2) n = 2, l = 0, 1

s-орб. р-орбитали – сколько их?
m = 2×1 + 1 = 3 – т.е. р-орбиталей три.
 .
.
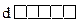
3) n = 3, l = 0, 1, 2;
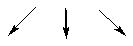
1 s-орб. 3 р-орб. d-орбитали – сколько их?
m = 2×2 + 1 = 5.
 .
.
4) n = 4, l = 0, 1, 2, 3

1 s-орб. 3 р-орб. 5d-орб. f-орбитали – сколько их?
m = 2l + 1 = 2×3 + 1 = 7.
 .
.
Спиновое квантовое число s. Характеризует собственное вращение электрона, которое имеет место наряду с его вращением по орбитали.”spin” – англ. «веретено, вращение». Величина векторная, принимает значения: 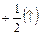 ;
;
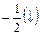 .
.
Т.к. на каждой орбитали может находиться не более 2-х электронов, отличающихся спинами, то максимальное число электронов на энергетическом подуровне находят по формуле: 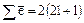 .
.
Принцип (запрет) Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел;
следствие – на одной орбитали может находиться не более двух электронов.
Правило Гундаучитывают при составлении электронно-графических формул:
1)При заполнении подуровня с несколькими одинаковыми орбиталями эти орбитали вначале заполняются по одному электрону, а когда не останется свободных – по второму электрону.
2)При заполнении орбиталей по одному электрону их спиновые числа должны быть одинаковы.
а)
| ¯ | |
суммарное спиновое число = 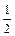 ,
,
б)
| | 
| |
суммарное спиновое число = 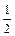 ,
,
в) правильные схемы:
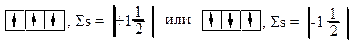
При составлении электронных формул следует помнить, что d-орбитали заполняются электронами с отставанием на один период, а f-орбитали – с отставанием на два периода:
- в 1 периоде2 элемента, т.к. на первом электронном слое имеются только 2 электрона (s);
- во 11 периоде8 элементов, что соответствует восьми электронам на втором электронном слое (s,p);
- в 111 периоде 8 элементов, хотя должно бы быть 18, т.к. на третьем слое может быть восемнадцать электронов (s, p, d). То есть d-орбитали на третьем слое не заполняются. Почему? Это отставание объясняется принципом минимальной энергии илиправилом Клечковского:электроны заполняют подуровни в порядке постепенного увеличения суммы главного и орбитального квантовых чисел (n + l); если для нескольких подуровней эти суммы принимают одинаковые значения, то вначале заполняются подуровни с меньшим значением числа n. Рассмотрим порядок заполнения орбиталей по всей Периодической таблице и сопоставим это со значениями сумм (n+l); для l берем цифровые значения ( у орбиталей s–формы l = 0; у p-орбиталей l = 1; у d–орбиталей l = 2; у f–орбиталей l = 3 ):
| Порядок заполнения | 1s | 2s | 2р | 3s | 3p | 4s | 3d | 4р | 5s | 4d | 5p | 6s | 4f |
| å (n + l) |
Валентные электроны – такие, которые могут принимать участие в образовании химической связи.
Все элементы Периодической системы можно разделить на 4 группы (семейства):
s-элементы: их валентные электроны находятся на s-орбиталях внешнего слоя; это первые два элемента каждого периода (например, 3Li: 1s22s1)
p-элементы:их валентные электроны находятся на s- и p-орбиталях внешнего слоя; это последние шесть элементов каждого периода (например,
9F: 1s22s22p5)
d-элементы: их валентные электроны находятся на s–орбиталях внешнего слоя и d–орбиталях предпоследнего слоя; это вставные десять элементов
больших периодов (например, 25Mn: 1s22s22p63s23p64s23d5)
f-элементы:их валентные электроны находятся на s-орбиталях внешнего слоя, d-орбиталях предпоследнего слоя и f-орбиталях третьего снаружи слоя (лантаноиды и актиноиды, например 59Pr: 1s 2 2s 2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f2).
Дата добавления: 2017-10-04; просмотров: 1315;











