Принципы построения электронных конфигураций атомов
Заселение электронами атомных орбиталей 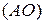 осуществляется согласно принципу Паули, правилу Гунда и принципу наименьшей энергии.
осуществляется согласно принципу Паули, правилу Гунда и принципу наименьшей энергии.
Принцип Паули (1925 г.): В атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
Поясним это на примере. Рассмотрим два электрона, которые находятся на одном энергетическом уровне, следовательно, у них одинаковые значения 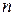 . Далее предположим, что они находятся на одном энергетическом подуровне, т.е.
. Далее предположим, что они находятся на одном энергетическом подуровне, т.е. 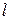 у них так же одинаковы. Наконец, оба электрона должны располагаться на одной
у них так же одинаковы. Наконец, оба электрона должны располагаться на одной 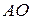 , т.е. значение
, т.е. значение 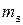 у них одно и то же, и чтобы это осуществить, у них должны быть противоположные спины.
у них одно и то же, и чтобы это осуществить, у них должны быть противоположные спины.
Из принципа Паули вытекают важные следствия.
Следствие 1. На атомной орбитали не может находиться более двух электронов в соответствии с двумя значениями спинового квантового числа 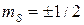 .
.
Следствие 2. Максимальное число электронов на данном подуровне:
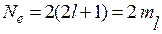
т.е. на каждом электронном подуровне находится количество электронов, равное удвоенному значению магнитного квантового числа.
Поскольку каждый подуровень содержит 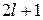 орбиталей (таблица
орбиталей (таблица 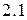 ), которые могут заселять только
), которые могут заселять только 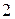 электрона, тогда максимально число электронов на подуровне будет равно:
электрона, тогда максимально число электронов на подуровне будет равно:
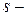 подуровень имеет
подуровень имеет 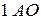 , следовательно, содержит
, следовательно, содержит 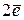 [1];
[1];
 подуровень имеет
подуровень имеет 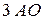 , следовательно, содержит
, следовательно, содержит 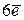 ;
;
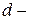 подуровень имеет
подуровень имеет 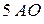 , следовательно, содержит
, следовательно, содержит  ;
;
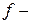 подуровень имеет
подуровень имеет  , следовательно, содержит
, следовательно, содержит 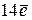 .
.
Следствие 3. Максимальное число электронов на уровне равно удвоенному значению квадрата главного квантового числа n:
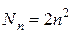
Эта формула получается после того, как мы просуммируем число электронов при заданном 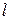 от
от 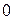 до
до 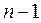 (формула Борна-Бьюри):
(формула Борна-Бьюри):
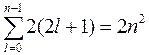
Она не учитывает межэлектронное взаимодействие и справедлива при 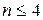 .
.
Правило Гунда: На данном подуровне электроны располагаются таким образом, чтобы суммарное спиновое число их было максимальным, т.е. только в этом случае электронная конфигурация обладает наименьшей энергией. При этом надо помнить, что суммарное спиновое число спаренных электронов равно нулю. Это означает, что если на 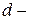 подуровне находится
подуровне находится 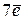 , то они располагаются так:
, то они располагаются так:
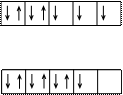
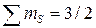 .
.
В противном случае суммарный спин будет меньше:
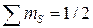 .
.
Принцип наименьшей энергии: Электроны в атоме не должны занимать вышестоящих энергетических уровней до тех пор, пока в нижележащих имеются свободные места, располагаясь на которых электроны будут обладать меньшей энергией.
Этот принцип отражает общую закономерность – максимуму устойчивости системы соответствует минимум её энергии.
Однако в такой формулировке принципом наименьшей энергии пользоваться весьма сложно. В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырёх квантовых чисел, но в этом случае электрон находится не только в поле ядра, а также в поле других электронов. Поэтому, учитывая, что энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, советским физиком В. М. Клечковским в 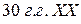 века были разработаны два правила, существенно облегчившие задачу размещения электронов в атомах:
века были разработаны два правила, существенно облегчившие задачу размещения электронов в атомах:
1. Электроны сначала занимают те уровни и подуровни, для которых сумма чисел 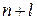 меньше.
меньше.
2. Если для каких-либо подуровней суммы 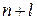 равны, то вначале идёт заполнение того подуровня, для которого число
равны, то вначале идёт заполнение того подуровня, для которого число 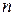 имеет меньшее значение.
имеет меньшее значение.
Энергия атомных орбиталей возрастает согласно следующему ряду: 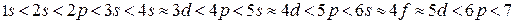 (рис.
(рис.  )
)
| Модель 2.3 |

Рисунок 2.5 – Последовательность заполнения атомных орбиталей электронами
Рассмотрим последовательное заполнение электронных оболочек атомов в соответствии с приведёнными правилами. В записи электронных формул (или конфигураций), отражающих эту последовательность, первая цифра равна 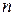 , буква после неё соответствует
, буква после неё соответствует 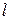 , а правый верхний индекс равен числу электронов в этом состоянии. Например, электронная формула лития –
, а правый верхний индекс равен числу электронов в этом состоянии. Например, электронная формула лития – 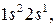 углерода –
углерода – 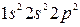 , хлора –
, хлора – 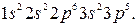 Заселённость электронных оболочек может быть представлена в виде квантовых ячеек (квадратов или горизонтальных линий) (рисунок
Заселённость электронных оболочек может быть представлена в виде квантовых ячеек (квадратов или горизонтальных линий) (рисунок  ).
).
В отличие от электронных формул здесь используются не два, а все четыре квантовых числа. Видно, что энергия электронов в многоэлектронных атомах определяется как квантовым числом 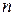 , так и
, так и 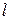 ; электроны отличаются значениями
; электроны отличаются значениями 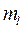 , а у спаренных электронов различнытолько спины. Свободная ячейка в нашем примере означает свободную
, а у спаренных электронов различнытолько спины. Свободная ячейка в нашем примере означает свободную  орбиталь, которую может занимать электрон при возбуждении атома.
орбиталь, которую может занимать электрон при возбуждении атома.

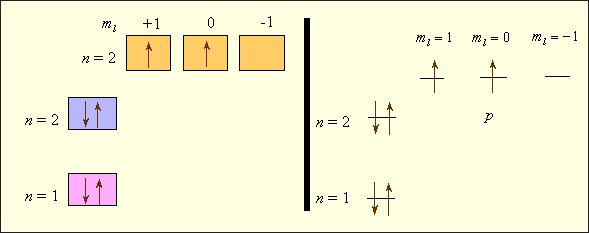
Рисунок 2.6 – Заселенность электронных оболочек, представленная в виде квантовых ячеек (квадратиков или горизонтальных линий)
[1]  - обозначение электрона.
- обозначение электрона.
Дата добавления: 2016-06-05; просмотров: 2945;











