Модель атома Резерфорда
СТРОЕНИЕ АТОМОВ
Ученые давно знали, что частицы разных веществ могут приобретать как положительные, так и отрицательные заряды. Об этом говорили многочисленные экспериментальные факты: трение, работа гальванических элементов, явление электролиза, прохождение электрического тока через разряженные газы – катодные лучи и т. д. Но только в работах Эрнеста Резерфорда и Нильса Бора эти разрозненные результаты получили первые научные объяснения.
Модель атома Резерфорда
В 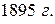 было открыто явление радиоактивности: некоторые вещества (названные радиоактивными) способны излучать невидимые «лучи», которые обладают большой проникающей способностью и могут «засвечивать» завёрнутую в тёмную бумагу фотопластинку. Причём природа этих лучей у разных веществ может отличаться и их классифицировали на
было открыто явление радиоактивности: некоторые вещества (названные радиоактивными) способны излучать невидимые «лучи», которые обладают большой проникающей способностью и могут «засвечивать» завёрнутую в тёмную бумагу фотопластинку. Причём природа этих лучей у разных веществ может отличаться и их классифицировали на 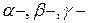 излучение. Позже определили, что
излучение. Позже определили, что 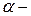 лучи – это ядра атомов
лучи – это ядра атомов 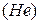 ,
, 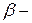 лучи – поток электронов, а
лучи – поток электронов, а 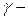 лучи – очень жесткое рентгеновское излучение.
лучи – очень жесткое рентгеновское излучение.
Изучая закономерности прохождения 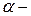 лучей через золотую фольгу, английский ученый Резерфорд в
лучей через золотую фольгу, английский ученый Резерфорд в 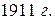 установил: атом представляет собой сложную систему, состоящую из положительно заряженного ядра, в котором и сосредоточена основная масса
установил: атом представляет собой сложную систему, состоящую из положительно заряженного ядра, в котором и сосредоточена основная масса 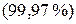 , и движущихся вокруг него отрицательно заряженных частиц – электронов. Это так называемая ядерная или планетарная модель атома. При всех химических превращениях ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения при этом претерпевают только электронные оболочки. Таким образом, химическая энергия связана только с энергией электронов.
, и движущихся вокруг него отрицательно заряженных частиц – электронов. Это так называемая ядерная или планетарная модель атома. При всех химических превращениях ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения при этом претерпевают только электронные оболочки. Таким образом, химическая энергия связана только с энергией электронов.
Если диаметр атомов приблизительно равен 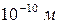 , то диаметр ядер
, то диаметр ядер 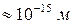 , т.е. в
, т.е. в 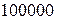 тысяч раз меньше.
тысяч раз меньше.
Электрон – это частица, обладающая элементарным отрицательным зарядом 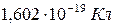 и массой покоя –
и массой покоя – 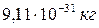 , т.е. в
, т.е. в 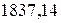 раза меньше массы атома водорода.
раза меньше массы атома водорода.
Однако эта теория противоречила известным экспериментальным данным. Укажем только два основных.
1. Основанная на законах классической термодинамики она принимала, что движение электрона вокруг ядра сопровождается непрерывным испусканием энергии в виде электромагнитных волн. Следовательно, генерируемое электроном электромагнитное поле, распространяясь в пространстве будет уносить кинетическую энергию электрона и за ничтожную долю секунды электрон должен будет слиться с ядром.
В действительности атом представляет собой весьма устойчивую систему.
2. Экспериментально было обнаружено, что спектр излучения газов и паров различных веществ не сплошной (как это следует из теории Резерфорда), а линейчатый (дискретный).
Таким образом, применение классических законов к явлениям микромира потерпело неудачу.
Модель атома Бора
Ещё в  году немецкий ученый Макс Планк выдвинул гипотезу, что энергия излучается не непрерывно, а определёнными порциями - квантами. Эту энергию несут частицы света – фотоны. При этом величина кванта энергии
году немецкий ученый Макс Планк выдвинул гипотезу, что энергия излучается не непрерывно, а определёнными порциями - квантами. Эту энергию несут частицы света – фотоны. При этом величина кванта энергии 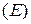 различна для различных излучений и пропорциональна частоте излучения
различна для различных излучений и пропорциональна частоте излучения 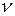 :
:
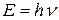 ,
, 
где 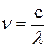 – частота излучения, т.е. число волн в секунду;
– частота излучения, т.е. число волн в секунду; 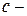 скорость света;
скорость света; 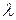 – длина волны;
– длина волны; 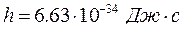 – постоянная Планка или квант энергии.
– постоянная Планка или квант энергии.
Исходя из теории квантов, датский физик Н. Бор в 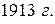 теоретически обосновал новую модель атома, в основе которой лежали два постулата:
теоретически обосновал новую модель атома, в основе которой лежали два постулата:
1. Электрон может вращаться вокруг ядра не по любым, а только по строго определённым (стационарным) орбитам, не излучая и не поглощая при этом энергию.
Этим постулатом сразу же устранялось первое противоречие теории Резерфорда, т.е. становилось понятно, почему атом является такой стабильной системой.
2. Поглощение или излучение энергии происходит только при переходе электрона с одной стационарной орбиты на другую.
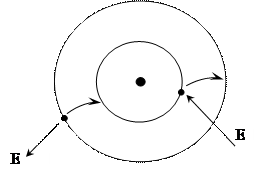 |
Смысл этого постулата состоит в том, что при поглощении кванта энергии происходит перескок электрона на более удалённую орбиту (рисунок
 ), и атом переходит в возбуждённое состояние. Энергия его связи с ядром уменьшается. Если же энергия излучается, то электрон переходит на более близкую к ядру орбиту. Таким образом, второй постулат объясняет дискретность спектров паров и газов.
), и атом переходит в возбуждённое состояние. Энергия его связи с ядром уменьшается. Если же энергия излучается, то электрон переходит на более близкую к ядру орбиту. Таким образом, второй постулат объясняет дискретность спектров паров и газов.
Рисунок 2.1
Теория Бора строго применима только к одному наиболее простому атому – атому водорода, для которого были вычислены не только «дозволенные» орбиты для электрона, но и радиусы этих орбит, орбитальные скорости электрона, потенциальная, кинетическая и полная энергии электрона на этих орбитах. Однако свойства многоэлектронных атомов не объяснялись с позиций этой теории, поэтому требовалось дальнейшее её совершенствование.
Дата добавления: 2016-06-05; просмотров: 1803;











