Корпускулярно-волновая природа электрона
В  французский физик Луи де Бройль предположил, что двойственной природой (корпускулярно-волновой) обладают не только фотоны-частицы света, но и электроны. Он исходил из следующего.
французский физик Луи де Бройль предположил, что двойственной природой (корпускулярно-волновой) обладают не только фотоны-частицы света, но и электроны. Он исходил из следующего.
Так как оба уравнения
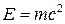 ,
, 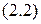
– уравнение Эйнштейна, связывающее массу и энергию фотона,
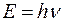 ,
, 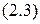
– уравнение Планка, связывающее энергию фотона и частоту излучения, относятся к одному и тому же объекту, то их можно приравнять. Тогда
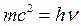 .
. 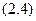
Напомним, что в физике произведение массы 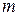 на скорость движения частицы
на скорость движения частицы 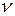 называют количеством движения или импульсом
называют количеством движения или импульсом 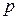 . Следовательно, для фотона
. Следовательно, для фотона 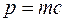 и уравнение
и уравнение 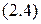 перепишем в виде
перепишем в виде
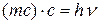
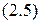
или 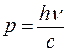
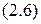
Поскольку для любого волнового процесса частота 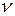 , длина волны
, длина волны 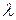 и скорость распространения волны u связаны соотношением
и скорость распространения волны u связаны соотношением
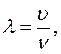
откуда 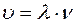
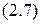
В частном случае для фотона 
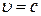 . Тогда из
. Тогда из 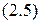 и
и 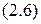 получим
получим
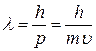 ,
, 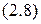
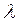 – длина волны электрона или длина волны де Бройля.
– длина волны электрона или длина волны де Бройля.
Например, для тела массой 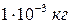 , имеющего скорость
, имеющего скорость 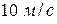 , длина волны де Бройля
, длина волны де Бройля 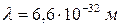 , т.е. зафиксировать такую волну даже с помощью самых совершенных приборов невозможно. Другое дело электрон, имеющий массу покоя
, т.е. зафиксировать такую волну даже с помощью самых совершенных приборов невозможно. Другое дело электрон, имеющий массу покоя 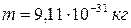 и скорость движения по орбите
и скорость движения по орбите 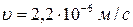 , для него
, для него  или
или 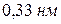 . А это уже порядок размеров атомов.
. А это уже порядок размеров атомов.
Открытие волновых свойств микрочастиц означало, что законы движения в микромире принципиально отличаются от привычных законов классической механики. Корпускулярно-волновая природа электрона, которая следует из уравнения Луи де Бройля 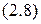 , связывающего массу частицы (корпускулярное свойство) с длиной волны (волновое свойство), свидетельствует о том, что на ряду со свойствами частицы (масса покоя, траектория и направление движения и др.) микрочастицы обладают и свойствами электромагнитного поля. Иначе говоря, с каждым движущимся электроном связан волновой процесс. В связи с этим частица с различной вероятностью, но одновременно может быть обнаружена в любой точке пространства, где происходит движение рассматриваемой волны. Рисунок
, связывающего массу частицы (корпускулярное свойство) с длиной волны (волновое свойство), свидетельствует о том, что на ряду со свойствами частицы (масса покоя, траектория и направление движения и др.) микрочастицы обладают и свойствами электромагнитного поля. Иначе говоря, с каждым движущимся электроном связан волновой процесс. В связи с этим частица с различной вероятностью, но одновременно может быть обнаружена в любой точке пространства, где происходит движение рассматриваемой волны. Рисунок  демонстрирует вышеизложенное.
демонстрирует вышеизложенное.
Если движущийся электрон в гипотетическом эксперименте удалось бы сфотографировать при его движении вокруг ядра через малые промежутки времени, то полученная картина напоминала бы облако, плотность которого неодинакова в объеме (рис. 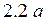 ). Очевидно, облако окажется наиболее плотным там, где выше вероятность нахождения электрона. Изменение электронной плотности с расстоянием
). Очевидно, облако окажется наиболее плотным там, где выше вероятность нахождения электрона. Изменение электронной плотности с расстоянием 
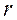 обычно изображается в виде кривой радиального распределения вероятности (рис.
обычно изображается в виде кривой радиального распределения вероятности (рис. 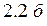 ). Эта кривая показывает, что нахождение электрона наиболее вероятно в оболочке радиуса
). Эта кривая показывает, что нахождение электрона наиболее вероятно в оболочке радиуса 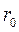 .
.
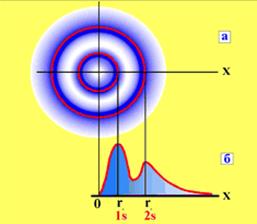
Рисунок 2.2. Распределение электронной плотности на 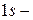 и
и 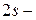 орбиталях: а) электронное облако атома с неравномерной плотностью; б) радиальное распределение вероятности для
орбиталях: а) электронное облако атома с неравномерной плотностью; б) радиальное распределение вероятности для 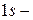 орбитали атома водорода.
орбитали атома водорода.
Новое представление об электроне заставило физиков отказаться от принятой модели атома, в которой электрон движется по определённым траекториям или орбитам. Поскольку электрон, обладая свойствами электромагнитной волны, движется по всему атомному объему, образуя электронное облако, плотность которого в той или иной части занимаемого пространства не одинакова, то оно получило название атомной орбитали (общепринятое сокращение 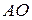 ). Таким образом, атомная орбиталь – это пространство вблизи ядра атома, в котором вероятность пребывания электрона наибольшая. Поверхность, ограничивающая
). Таким образом, атомная орбиталь – это пространство вблизи ядра атома, в котором вероятность пребывания электрона наибольшая. Поверхность, ограничивающая 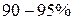 вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию.
вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию.
Двойственную природу электрона и других элементарных частиц удалось объяснить немецкому физику В. Гейзенбергу с помощью принципа неопределённости: невозможно в любой данный момент времени определить сколь угодно точно и положение частицы в пространстве, и её скорость (импульс).Это обусловлено тем, что измерения проводятся каким-либо прибором, который фиксирует взаимодействие электрона с носителем этой информации, например, фотоном или другой частицей. Следовательно, неминуемо происходит взаимодействие этих частиц, хотя бы посредством их электромагнитных полей, а это приводит к тому, что существенно изменяется или положение электрона, или его скорость и её направление.
| Модель 2.1 |
Количественно это соотношение может быть записано в виде:
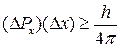
Здесь 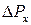 – неопределённость в величине импульса, направленного вдоль оси
– неопределённость в величине импульса, направленного вдоль оси  ;
; 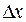 – неопределённость в положении частицы вдоль этой же координаты. Отсюда вытекает, что чем точнее определено положение частицы в пространстве
– неопределённость в положении частицы вдоль этой же координаты. Отсюда вытекает, что чем точнее определено положение частицы в пространстве 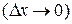 , тем больше неопределённость его импульса, т.е. скорости. Кроме того, энергия микрочастицы ни при каких условиях не может быть равна нулю, так как при
, тем больше неопределённость его импульса, т.е. скорости. Кроме того, энергия микрочастицы ни при каких условиях не может быть равна нулю, так как при 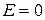 её координаты и импульс были бы точно известны, это противоречит принципу неопределённости. Таким образом, движение микрочастиц в системе не может прекратиться даже при абсолютном нуле температур.
её координаты и импульс были бы точно известны, это противоречит принципу неопределённости. Таким образом, движение микрочастиц в системе не может прекратиться даже при абсолютном нуле температур.
Новый раздел физики и химии, который изучает явления, происходящие в микромире, получил название квантовой или волновой механики. Основой её служит уравнение Э. Шредингера, учитывающее не только все взаимодействия электронно-ядерных систем, но и волновые свойства электронов. Однако точное решение удалось получить только для атома водорода или водородоподобных ионов, для многоэлектронных систем необходимо использовать различные приближения. Таким образом, для полной характеристики электрона в атоме оказалось достаточным иметь четыре параметра – квантовые числа, три из которых характеризуют пространственное распределение электрона в атомной орбитали, и вытекают из решения уравнения Шредингера.
Квантовые числа
1. Главное квантовое число 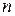 характеризует:
характеризует:
- число энергетических уровней в атоме;
- энергию электрона на данном энергетическом уровне;
- размер атома.
В общем случае 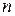 принимает значения от
принимает значения от 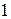 до
до 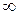 . В невозбуждённых атомах, т.е. таких, состояние которых соответствует их расположению в периодической системе элементов Д. И. Менделеева,
. В невозбуждённых атомах, т.е. таких, состояние которых соответствует их расположению в периодической системе элементов Д. И. Менделеева, 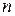 изменяется от
изменяется от 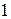 до
до 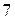 в соответствии с числом периодов в периодической системе. Чем меньше
в соответствии с числом периодов в периодической системе. Чем меньше 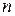 , тем больше энергия взаимодействия электрона с ядром. Например, при
, тем больше энергия взаимодействия электрона с ядром. Например, при 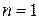 атом водорода находится в основном состоянии, при
атом водорода находится в основном состоянии, при 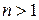 – в возбуждённом.
– в возбуждённом.
| Модель 2.2 |
В многоэлектронных атомах электроны с одинаковыми значениями 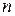 образуют слой или уровень обозначаемый буквами
образуют слой или уровень обозначаемый буквами 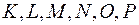 и
и  . Буква
. Буква 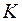 соответствует первому уровню,
соответствует первому уровню, 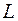 – второму и т.д.
– второму и т.д.
2. Орбитальное или побочное квантовое число 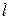 характеризует:
характеризует:
– Энергию электрона на энергетическом подуровне.
 |
На уровне может находиться много электронов (максимально
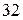 ), но не все они обладают одинаковой энергией. В результате взаимного отталкивания электронов происходит расщепление энергетического уровня на подуровни (рисунок
), но не все они обладают одинаковой энергией. В результате взаимного отталкивания электронов происходит расщепление энергетического уровня на подуровни (рисунок 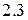 ).
).
Рисунок 2.3 Расщепление энергетического уровня на подуровни
Те электроны, которые принадлежат одному и тому же подуровню, т.е. электроны с одинаковыми значениями 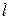 , обладают одинаковой энергией. Такое состояние называют вырожденным по энергии.
, обладают одинаковой энергией. Такое состояние называют вырожденным по энергии.
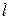 принимает значения от
принимает значения от 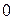 до
до 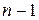 , но это правило справедливо для невозбуждённых атомов для
, но это правило справедливо для невозбуждённых атомов для 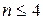 . Кроме числовых значений,
. Кроме числовых значений, 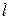 имеет и буквенные обозначения:
имеет и буквенные обозначения:
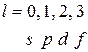
Так, при 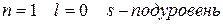
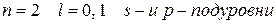
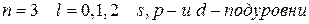
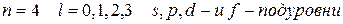 ,
,
т.е. число энергетических подуровней в пределах данного энергетического уровня;
- Форму атомных орбиталей (рисунок 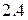 ).
).
3. Магнитное квантовое число 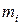 определяет:
определяет:
- ориентацию атомных орбиталей в пространстве;
- число атомных орбиталей на энергетическом подуровне.
 принимает целые значения от
принимает целые значения от 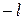 через
через 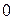 до
до 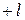 , т.е.
, т.е. 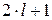 значений. Например, рассмотрим
значений. Например, рассмотрим  подуровень, для него
подуровень, для него 
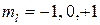 – всего
– всего 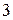 значения. Следовательно, число
значения. Следовательно, число 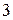 означает, что на данном энергетическом подуровне находится три атомных орбитали, различным образом ориентированных в пространстве (рисунок
означает, что на данном энергетическом подуровне находится три атомных орбитали, различным образом ориентированных в пространстве (рисунок 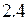 ).
).
Вышеизложенное можно представить в виде таблицы 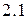 .
.
Таблица 2.1 - Число орбиталей на энергетических подуровнях
| 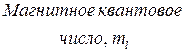
| 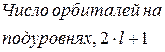
|
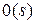
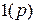
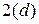
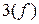
| 

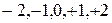
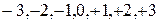
| 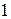
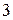
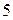
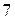
|
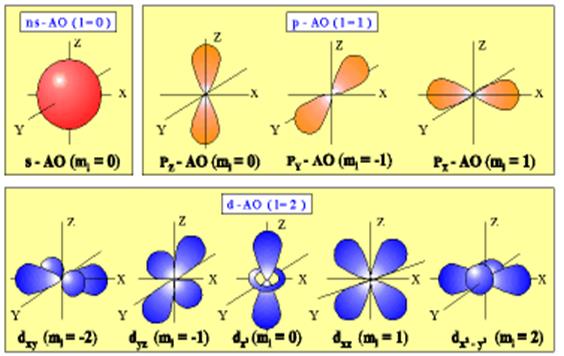
Рисунок 2.4. Конфигурации атомных орбиталей и ориентация их в пространстве
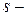 орбитали сферически симметричны для любого n и отличаются друг от друга только размерами сферы.
орбитали сферически симметричны для любого n и отличаются друг от друга только размерами сферы.
 орбитали существуют при
орбитали существуют при 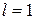 , поэтому возможны три варианта ориентации в пространстве:
, поэтому возможны три варианта ориентации в пространстве: 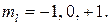 Все
Все  орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом
орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 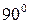 друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются
друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются 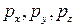 .
.
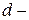 орбитали определяются квантовым числом
орбитали определяются квантовым числом  , при котором
, при котором  то есть характеризуются пятью вариантами ориентации в пространстве.
то есть характеризуются пятью вариантами ориентации в пространстве. 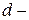 орбитали, ориентированные по осям координат, обозначаются
орбитали, ориентированные по осям координат, обозначаются 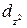 и
и 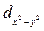 , а ориентированные по биссектрисам координатных углов -
, а ориентированные по биссектрисам координатных углов - 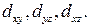
Семь 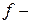 орбиталей, соответствующих
орбиталей, соответствующих 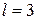 , имеют ещё более сложную конфигурацию и на рисунке
, имеют ещё более сложную конфигурацию и на рисунке 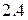 не показаны.
не показаны.
4. Спиновое квантовое число 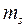 (от английского
(от английского  – вращение) упрощено можно представить как описывающее вращение электрона вокруг собственной оси по часовой стрелке и против, поэтому оно имеет только два значения
– вращение) упрощено можно представить как описывающее вращение электрона вокруг собственной оси по часовой стрелке и против, поэтому оно имеет только два значения 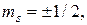 представляющие собой две проекции углового момента электрона на выделенную ось.
представляющие собой две проекции углового момента электрона на выделенную ось.
 Для изображения атомной орбитали и электронов часто используют «квадратики» и «стрелки», направленные вверх или вниз. Два электрона с одинаковыми значениями квантовых чисел
Для изображения атомной орбитали и электронов часто используют «квадратики» и «стрелки», направленные вверх или вниз. Два электрона с одинаковыми значениями квантовых чисел 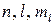 , но с противоположно направленными спинами, называются спаренными или неподелённой электронной парой и обозначаются , неспаренные электроны – или .
, но с противоположно направленными спинами, называются спаренными или неподелённой электронной парой и обозначаются , неспаренные электроны – или .
Итак, четыре квантовые числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
Дата добавления: 2016-06-05; просмотров: 4494;











