ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА— (ХТ)
Химическая термодинамика даёт возможность инженеру-технологу осмыслить и усвоить суть происходящих технологических процессов, а также решать задачи, связанные с производственной, проектной и научно- исследовательской деятельностью.
ХТ позволяет:
1. Рассчитать тепловой эффект процесса, на базе которого можно определить тепловой баланс технологического цикла, а затем и всего производства;
2. Определить возможность, направление и полноту протекания самопроизвольных процессов и условия равновесия;
3. Рассмотреть оптимальные условия проведения процесса и его изменение в зависимости от внешних условий, главным образом от температуры и давления.
Практическая значимость химической термодинамики заключается в том, что на базе ее законов и положений находят числовые значения параметров, которые дают качественные представления о происходящих процессах. Одним из таких параметров является теплота, которая выделяется или поглощается в результате химического или физико-химического процесса.
Особенности термодинамики:
1. Термодинамический метод применим только к большому числу частиц;
2. Термодинамика дает возможность проведения расчетов без учета механизма процесса;
3. Термодинамика не учитывает скорость протекания того или иного процесса.
Все процессы и явления в термодинамики рассматриваются применительно к термодинамической системе. Существует несколько определений термодинамической системы. Заметим, что часто слово «термодинамическая» опускается и ограничиваются словом «система».
Термодинамическая система—это совокупность тел взаимодействующих между собой и обособленных от окружающей среды реальной или воображаемой оболочкой (границей).
Система делится на 3 типа:
| Открытые | Закрытые | Изолированные |
| Обмениваются с окружающей средой веществом и энергией (напр., теплообменники, насосы, смесители, фильтры и др.) | Обмениваются с окружающей средой только энергией (напр., батарея центрального отопления, консервная банка). | Ничем не обменивается с окружающей средой (напр., холодильник, термос). |
Любая система характеризуется состоянием, параметрами состояния.
Различают экстенсивные и интенсивные параметры.
Экстенсивные параметры, которые зависят от общего количества вещества в системе (V- объём, n-количество, m- масса, C-концентрация, S- энтропия).
Интенсивные параметры—не зависят от количества вещества в системе (T-температура, P-давление, Cp-изобарная теплоемкость, μ- хим. потенциал, N-мольная доля).
Переход системы из одного состояния в другое вследствие изменения хотя одного из параметров, называется процессом.
Термодинамическим параметром называется любая из термодинамических величин, которая служит для характеристики процесса.
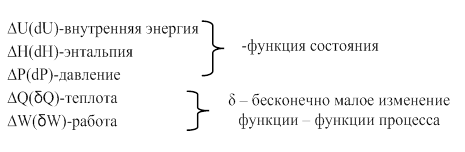
∆, d, δ – изменение параметров.
Изменение — это разность между конечным и начальным параметром состояния системы.
Функций состояния называется функция, изменение которой не зависит от пути протекания процесса, а определяется только начальными и конечными параметрами (состоянием системы).
∆P = P2(конеч.) - P1 (начал.) — функция состояния (ф.с.).
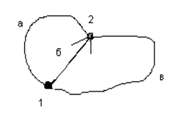 Переход из состояния 1 в состояние 2 может быть осуществлены различными путями (а,б,в). Причем величина ∆P не зависит от пути перехода даже в том случае, когда в процессе из одного состояния в другое промежуточное значения функции состояния могут превышать ее конечное значение (напр., кривая в).
Переход из состояния 1 в состояние 2 может быть осуществлены различными путями (а,б,в). Причем величина ∆P не зависит от пути перехода даже в том случае, когда в процессе из одного состояния в другое промежуточное значения функции состояния могут превышать ее конечное значение (напр., кривая в).
ВНУТРЕННЯЯ ЭНЕРГИЯ. ТЕПЛОТА И БАБОТА. СВЯЗЬ МЕЖДУ НИМИ
Внутренняя энергия (U) — это совокупность всех видов энергий частиц, составляющих данное тело, без учета потенциальной и кинетической энергии в целом. Экстенсивная величина.
Энергию можно передать двумя способами:
1. В виде теплоты (за счет хаотического движения частиц) – молекулярно-микроскопический метод (Q, q)- [Дж], кал = 4,1868 (Дж=Н*м)
2. В виде работы (за счет направленного действия одного тела над другим) – макроскопический вид передачи энергии (W, A) - [Дж].
Теплота и работа — это функции процесса, т.к. например, количество теплоты, выделяемой или поглощаемой при переходе системы из одного состояния 1 в состояние 2, зависит от пути перехода.
Для химических и физико-химических процессов передача теплоты часто происходит при постоянном давлении. По этой причине большее практическое значение по сравнению с внутренней энергией приобретает энтальпия.
Если система окружена упругой средой(газом, жидкостью), дополнительно к внутренней энергии она обладает ещё и определенным запасом потенциальной энергии, которая равна произведению давления в системе на ее объем pV. Давление в системе противодействует окружающей среде — ее стремлению сжать систему. Полную энергию подобной системы называют энтальпией и обозначают через ∆Н.
∆Н=∆U+p∆V;
dH=dU+pdV, при p=const
Внутренняя энергия и энтальпия — это функция состояния, т.е. их изменение определяется заданными начальными конечными состояниями системы и не зависят от пути перехода.
Процессы, при которых теплота выделяется, называется — экзотермическими, а процессы, при которых теплота поглощается — эндотермическими.
Q>0 (∆H<0) – экзотермический (выделение) энергии;
Q<0 (∆H>0) – эндотермический (поглощение) энергии.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Математическое выражение I закона термодинамики:

Теплота, сообщаемая системе, идет на приращение внутренней энергии и на работу, совершаемую системой.
Q и W –функции процесса (зависят то пути протекания процесса).
Первый закон (или начало) термодинамики, как и остальные законы, является постулатом: оно не может быть доказано логическим путем, а выражается из суммы человеческого опыта.
3- постулата I-закон термодинамики:
1. Разные формы энергии переходят друг в друга в строго эквивалентных количествах;
2. В любой изолированной системе запас внутренней энергии остается постоянным;
3. Невозможно получить работу без затраты энергии.

Пользуясь математическим выражением I закона термодинамики, можно дать термодинамическое определение понятия внутренней энергии как величины, изменение которой является следствием передачи теплоты и совершения работы.
dU= δQ +δW
Первое начало термодинамики можно представить: δQ= dU+ pdV+δW’
Именно полезная работа, которая можно получить в результате химических превращений, важна для практики. Примером полезной работы является работа, получаемая с помощью гальванического элемента. В нем химическая энергия превращения в электрическую, которую можно использовать для различных практических целей.
Для идеальных газов полезная работа (δW’=0).
δQ = dU + pdV – работа расширения
Для изолированных системах: U =const
δQ = 0
dV = 0
dU=0 → U=const, т.е. внутренняя энергия изолированной системы есть величина постоянная.
| <== предыдущая лекция | | | следующая лекция ==> |
| Гидродинамическое подобие (подобные преобразования уравнений Навье-Стокса) и вывод основных критериев ГД подобия. | | | Машины для уплотнения грунтов |
Дата добавления: 2017-09-01; просмотров: 2253;











