В. Понижение температуры замерзания
Вторым коллигативным свойством растворов является понижение температуры замерзания.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давления насыщенного пара растворителя над кристаллами и над раствором одинаковы, т. е. когда кривая давления пара над кристаллами (кривая А0В на рис. 25.1 имеет общую точку с соответствующей кривой испарения (точка A0для чистого растворителя, точки А1иА2для растворов m1 и m2соответственно).
Как видно из рис. 25.1, температура замерзания раствора ниже температуры замерзания чистого растворителя. Понижение температуры замерзания 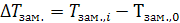 пропорционально моляльной концентрации раствора m. Оно выражается для растворов неэлектролитов уравнением
пропорционально моляльной концентрации раствора m. Оно выражается для растворов неэлектролитов уравнением
ΔТзам. = Кзам.m,(25.4)
а для растворов электролитов уравнением
ΔТзам..= Кзам.im(25.5)
В этих уравнениях Кзам - криоскопическая постоянная растворителя, не зависящая от природы растворенного вещества. Для воды Кзам. = 1,86, для бензола Кзам. = 5,07, для циклогексана Кзам. = 20 . Криоскопическая постоянная выражается через удельную теплоту плавления чистого растворителя (Δhпл.,0) и его температуру замерзания (Тзам.,0) уравнением
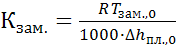 (25.6)
(25.6)
На уравнении (25.6) основан криоскопический метод определения молярных масс нелетучих соединений.
Если при приготовлении раствора весовым методом массы растворенного вещества и растворителя (г) составляли g1 и g2, а молярная масса растворенного нелетучего вещества равна М2, то g2/M2 - число молей растворенного вещества на gi г растворителя. Число молей на 1000 г растворителя, т. е. моляльность раствора, можно рассчитать по формуле
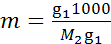 .
.
Подставив это выражение в уравнение (9.19) и решив его относительно М2, можно получить формулу для расчета молярной массы растворенного вещества по понижению температуры замерзания раствора
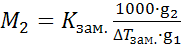 . (25.7)
. (25.7)
Молярную массу растворенного вещества можно определить и эбулиоскопическим методом:
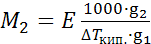 . (25.8)
. (25.8)
но он используется реже, чем криоскопический, так как менее точен из-за возможного перегрева при кипении жидкости и из-за меньшей величины Е (и ΔТкип.) по сравнению с Кзам.(и ΔТзам.).
Дата добавления: 2017-09-01; просмотров: 1679;











