С. Осмотическое давление.
Третьим коллигативным свойством растворов является осмотическое давление ( 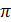 ).
).
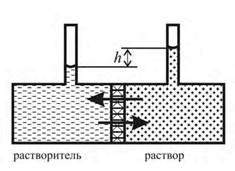
| Рис. 25.2. Схема возникновения осмотического давления в сосуде. |
 Осмосом называется проникновение растворителя в раствор, отделенный от него полупроницаемой мембраной (т. е. проницаемой для растворителя, но не для растворенного вещества). Осмос играет большую роль в природе, поскольку оболочки животных и растительных клеток являются полупроницаемыми мембранами. Осмос воды внутрь клеток создает там давление порядка 1-20 атм, что обуславливает прочность и упругость тканей. Питание кроны деревьев, набухание семян, чувство жажды и т. д. - все это проявления осмоса.
Осмосом называется проникновение растворителя в раствор, отделенный от него полупроницаемой мембраной (т. е. проницаемой для растворителя, но не для растворенного вещества). Осмос играет большую роль в природе, поскольку оболочки животных и растительных клеток являются полупроницаемыми мембранами. Осмос воды внутрь клеток создает там давление порядка 1-20 атм, что обуславливает прочность и упругость тканей. Питание кроны деревьев, набухание семян, чувство жажды и т. д. - все это проявления осмоса.
Полупроницаемые перегородки могут быть как растительного, так и животного происхождения. Осмотическими свойствами обладают также пленки из некоторых органических веществ.
На рис.25.2 показана схема возникновения осмотического давления. Согласно закону Рауля, давление насыщенного пара растворителя над раствором ниже, чем над чистым растворителем. Соответственно химический потенциал растворителя в растворе меньше, чем в чистом растворителе. Поэтому если в две части сосуда, разделенного полупроницаемой перегородкой, залить до одинакового уровня растворитель и раствор, то растворитель через полупроницаемую перегородку будет переходить из той части сосуда, где залит чистый растворитель, в ту часть, где находится раствор (т. е. процесс пойдет самопроизвольно в направлении выравнивания фактора интенсивности - химического потенциала растворителя). Соответственно уровень растворителя будет понижаться, а уровень раствора - повышаться до тех пор, пока в системе не установится равновесие. Гидростатическое давление, пропорциональное разности уровней h при равновесии, по абсолютной величине будет равно осмотическому давлению 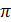 .
.
Переходу растворителя через полупроницаемую перегородку можно воспрепятствовать, создав над раствором повышенное давление. Осмотическим давлением называется давление, при приложении которого к раствору осмос прекращается.
Для идеальных растворов на основании термодинамических соображений можно вывести уравнение Вант-Гоффа
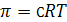 , (25.9)
, (25.9)
аналогичное уравнению состояния идеальных газов
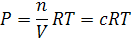
Таким образом, осмотическое давление разбавленных растворов численно равно тому давлению, которое производил бы газ, если бы он при данной температуре занимал объем, равный объему раствора, и содержал бы столько же частиц, сколько молекул растворенного вещества в растворе.
Из данных по осмотическому давлению, так же как и из других коллигативных свойств, можно найти молярную массу растворенного вещества. Все коллигативные свойства растворов часто используют для определения активностей компонентов в бинарных растворах.
Дата добавления: 2017-09-01; просмотров: 1347;











