Химические свойства аминов.
Так как амины, являясь производными аммиака, имеют сходное с ним строение (т.е. имеют неподеленную пару электронов в атоме азота), то они и проявляют подобные ему свойства. Т.е. амины, как и аммиак, являются основаниями, так как атом азота может предоставлять электронную пару для образования связи с электроннедостаточными частицами по донорно-акцепторному механизму (соответствие определению основности по Льюису).
I. Свойства аминов как оснований (акцепторов протонов)
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
CH3NH2 + H2O  CH3NH3+ + OH−
CH3NH3+ + OH−

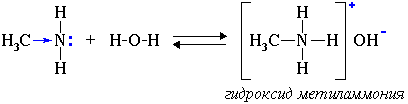
Анилин с водой практически не реагирует.
Водные растворы имеют щелочной характер:
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:
C6H5NH2 + HCl → (C6H5NH3)Cl
хлорид фениламмония
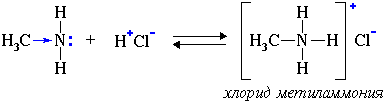
2CH3NH2 + H2SO4 → (CH3NH3)2SO4
сульфат метиламмония
Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимы в неполярных жидкостях. При реакции с щелочами выделяются свободные амины:
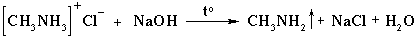
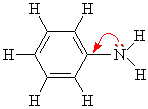
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с π-электронами ароматического ядра, что уменьшает электронную плотность на атоме азота (-М-эффект). Напротив, алкильная группа является хорошим донором электронной плотности (+I-эффект)..
 или
или 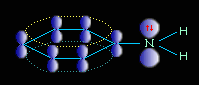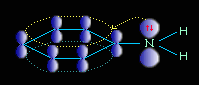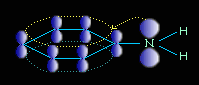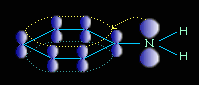

Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
У атома азота в молекулах аминов есть неподеленная пара электронов, которая может участвовать в образовании связи по донорно-акцепторному механизму.
В ряду
анилин  аммиак
аммиак  первичный амин
первичный амин  вторичный амин
вторичный амин  третичный амин
третичный амин
электронная плотность на атоме азота возрастает.
Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства.
В ряду
анилин  аммиак
аммиак  первичный амин
первичный амин  вторичный амин
вторичный амин
основные свойства усиливаются, из-за влияния типа и числа радикалов.
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
II. Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. Ароматические амины самопроизвольно окисляются на воздухе. Так, анилин быстро буреет на воздухе вследствие окисления.
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2↑
4C6H5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
III. Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl → НNO2 + KCl
или NO2− + H+ → НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
· Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 → R-OH + N2↑ + H2O
- Огромное значение имеет реакция диазотирования первичных ароматических аминов под действием азотистой кислоты, получаемой по реакции нитрита натрия с соляной кислотой. А в последствии образуется фенол:

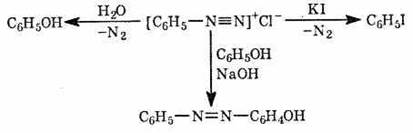
· Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в N-нитрозопроизводные (вещества с характерным запахом):
R2NH + H-O-N=O → R2N-N=O + H2O
алкилнитрозамин
· Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
IV. Особые свойства:
1. Образование комплексных соединений с переходными металлами:

2. Присоединение алкилгалогенидов Амины присоединяют галогеналканы с образованием соли:
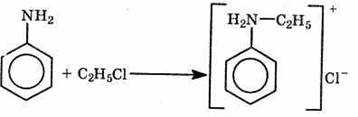
Обрабатывая получившуюся соль щелочью, можно получить свободный амин:

V. Ароматическое электрофильное замещение в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
В ароматических аминах аминогруппа облегчает замещение в орто- и пара-положениях бензольного кольца. Поэтому галогенирование анилина происходит быстро и в отсутствие катализаторов, причем замещаются сразу три атома водорода бензольного кольца, и выпадает белый осадок 2,4,6-триброманилина:

Эта реакция бромной водой используется как качественная реакция на анилин.
В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
4. Способы получения аминов.
1. Реакция Гофмана. Один из первых методов получения первичных аминов − алкилирование аммиака алкилгалогенидами:

Это не самый лучший метод, так как в результате получается смесь аминов всех степеней замещения:

и т.д. Алкилирующими агентами могут выступать не только алкилгалогениды, но и спирты. Для этого смесь аммиака и спирта пропускают над оксидом алюминия при высокой температуре.
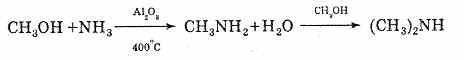
2. Реакция Зинина — удобный способ получения ароматических аминов при восстановлении ароматических нитросоединений. В качестве восстановителей используются: H2 (на катализаторе). Иногда водород генерируют непосредственно в момент реакции, для чего обрабатывают металлы (цинк, железо) разбавленной кислотой.

2HCl + Fe(стружка) → FeCl2 + 2H
C6H5NO2 + 6[H]  C6H5NH2 + 2H2O.
C6H5NH2 + 2H2O.
В промышленности эта реакция протекает при нагревании нитробензола с водяным паром в присутствии железа. В лаборатории водород "в момент выделения" образуется по реакции цинка со щелочью или железа с соляной кислотой. В последнем случае образуется хлорид анилиния.
3. Восстановление нитрилов. Используют LiAlH4:

4. Ферментатичное декарбоксилирование аминокислот:

5. Применение аминов.
Амины применяются в фармацевтической промышленности и органическом синтезе (CH3NH2, (CH3)2NH, (C2H5)2NH и др.); при производстве найлона (NH2-(CH2)6-NH2 − гексаметилендиамин); в качестве сырья для производства красителей и пластмасс (анилин), а также пестицидов.
Список используемых источников:
- О.С. Габриелян и др. Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учрждений; Дрофа, Москва, 2005г.;
- «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001;
- https://www.calc.ru/Aminy-Svoystva-Aminov.html
- http://www.yaklass.ru/materiali?mode=lsntheme&themeid=144
- http://www.chemel.ru/2008-05-24-19-21-00/2008-06-01-16-50-05/193-2008-06-30-20-47-29.html
- http://cnit.ssau.ru/organics/chem5/n232.htm
Дата добавления: 2017-06-13; просмотров: 19002;











