Химический потенциал и его свойства
До сих пор нами рассматривались закрытые системы, в которых масса оставалась постоянной. Однако очень часто приходится иметь дело с системами, в которых число частиц и масса переменны (открытыми системами). Причинами изменения массы являются массообмен через оболочку системы, фазовые превращения, излучение, химические реакции, ядерные реакции.
Пусть однокомпонентная однофазная термодинамическая система является открытой, однородной и равновесной. Изменение внутренней энергии такой системы будет происходить не только вследствие подвода теплоты и совершения над ней работы, но также и вследствие изменения ее массы в силу того, что вещество, проникающее через оболочку, обладает энергией, а фундаментальные уравнения Гиббса для термодинамических потенциалов следует дополнить еще одним слагаемым, пропорциональным изменению массы системы:
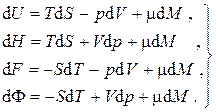
Величина μ, определяемая частными производными
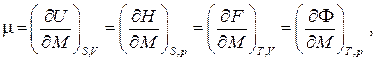
носит название химического потенциалаи имеет смысл изменения энергии термодинамической системы при изменении ее массы на единицу при поддержании постоянной той или иной пары независимых термодинамических параметров системы.
Найдем связь химического потенциала с другими термодинамическими потенциалами системы. Запишем свободную энергию Гиббса Φ, энтропию S и объем системы V через их удельные величины:
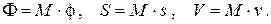
Заменяя дифференциал свободной энергии Гиббса его выражением 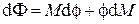 и перегруппировав слагаемые, получим
и перегруппировав слагаемые, получим
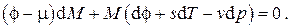
Для удельных величин 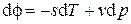 , откуда, ввиду произвольности дифференциала массы dM , находим
, откуда, ввиду произвольности дифференциала массы dM , находим
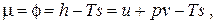
т.е. химический потенциал вещества есть его удельная свободная энергия Гиббса. Для идеального газа, используя выражения для энтальпии и энтропии, химический потенциал будет иметь вид
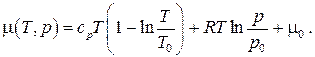
Лекция 10
Дата добавления: 2021-07-22; просмотров: 527;











