Тяжелые металлы в атмосфере, в водной экосистеме, в почве.
Поведение этих токсикантов в различных природных средах обусловлено специфичностью их основных биогеохимических свойств: комплексообразующей способностью, подвижностью, биохимической активностью, минеральной и органической формами распространения, склонностью к гидролизу, растворимостью, эффективностью накопления. По характеру взаимодействия с различными лигандами тяжёлые металлы считаются промежуточными акцепторами между жёсткими и мягкими кислотами. В первом случае для них характерны низкие поляризуемость и электроотрицательность, высокая степень окисления и образование ионных связей; во втором – образование преимущественно ковалентных связей.
Определённая аналогия биогеохимических свойств некоторых тяжёлых металлов позволила сгруппировать эти элементы и выявить общие закономерности их токсикологического воздействия на окружающую среду (табл. 7).
Таблица 7. Основные биогеохимические свойства тяжёлых металлов
| Свойства | Co | Ni | Cu | Zn | Cd | Hg | Pb |
| Биохимическая активность | - | В | В | В | В | В | В |
| Токсичность | У | У | У | У | В | В | В |
| Канцерогенность | В | В | - | - | - | - | - |
| Обогащение глобальных аэрозолей | Н | Н | В | В | В | В | В |
| Минеральная форма распространения | В | Н | Н | Н | В | В | В |
| Органическая форма распространения | Н | Н | У | У | В | В | В |
| Подвижность | Н | Н | У | У | В | В | В |
| Тенденция к биоконцентрированию | В | В | У | У | В | В | В |
| Эффективность накопления | У | У | В | В | В | В | В |
| Комплексообразующая способность | Н | Н | В | В | У | У | Н |
| Склонность к гидролизу | Н | У | В | В | У | У | У |
| Растворимость | Н | Н | В | В | В | В | В |
| Время жизни | В | В | В | В | Н | Н | Н |
Примечания: В – высокая, У – умеренная, Н – низкая.
Так, медь и цинк характеризуются как наибольшей химической активностью, так и высокой эффективностью накопления в водорослях и планктоне, что определяет их особую значимость для биоты. Они являются главными составляющими многих металлоферментов, участвующих в природной селекции аэробных клеток, в окислительно-восстановительных процессах тканей, иммунной реакции, стабилизации рибосом и мембран клеток.
Никель и кобальт – биологически активные и канцерогенные. Сравнительно малая подвижность этих элементов обуславливает их достаточно равномерное распределение в природных средах.
Геохимические особенности свинца – малая подвижность и непродолжительное время жизни в атмосфере и фазе раствора природных вод. В поверхностных водах оно составляет несколько лет, а в глубинных – до 100 лет.
По химическим свойствам и специфике поведения в различных природных средах кадмий имеет определённую аналогию с цинком. Высокая токсичность и растворимость этого элемента обусловлены большим сродством к SH-группам. В отличие от ртути, сродство кадмия к кислороду выражено менее ярко, что объясняет образование его достаточно неустойчивых металлорганических соединений и определённую инертность в окислительно-восстановительных реакциях. Кадмий склонен к активному биоконцентрированию, что приводит в довольно короткое время к его накоплению в избыточных биодоступных концентрациях. Поэтому кадмий, по сравнению с другими тяжёлыми металлами, является наиболее сильным токсикантом почв (Cd > Ni > Cu > Zn).
Ртуть – один из самых токсичных элементов в природных экосистемах. По токсикологическим свойствам соединения ртути классифицируются на следующие группы: элементная ртуть, неорганические соединения, алкилртутные (метил- и этил-) соединения с короткой цепью и другие ртутьорганические соединения, а также комплексные соединения ртути с гумусовыми кислотами. Из этих соединений ртути наиболее токсичны для человека и биоты ртутьорганические соединения. Их доля в речных водах составляет 46% от общего содержания, в донных отложениях – до 6%, в рыбах до 80 – 95%. Как неорганические, так и органические соединения ртути высокорастворимы.
Степень загрязнения окружающей среды токсикантами во многом определяется их химически активными миграционными формами и механизмом миграции. Миграция элементов – это перенос и перераспределение химических элементов в земной коре и на поверхности земли.
Сложность биогеохимических процессов, происходящих в атмосферном воздухе, атмосферных осадках, природных водах, донных отложениях, почвах, не позволяет высказать однозначной точки зрения на соединения тяжёлых металлов, определяющих их подвижные формы, и преобладание одной из них в естественных и техногенных процессах.
Однако можно отметить следующее: в атмосферном воздухе и атмосферных осадках тяжёлые металлы находятся и мигрируют в газообразной и аэрозольной формах, а также в форме органических и неорганических комплексных соединений; в природных водах – в форме свободных ионов, моноядерных гидроксокомплексов, неорганических (сульфатные, хлоридные, карбонатные) и органических (фульватные, гуматные) соединений, взвешенных и коллоидных формах; в донных отложениях – преимущественно во взвешенных формах органического происхождения; в почвах – в водорастворимых ионообменных и непрочно адсорбированных формах.
Трансформация тяжёлых металлов
Особое значение приобрело загрязнение биосферы группой поллютантов, получивших общее название «тяжёлые металлы» (ТМ). К ним относят более 40 химических элементов периодической системы Д. И. Менделеева с атомными массами свыше 50 а. е. м. Иногда тяжёлыми металлами называют элементы, которые имеют плотность более 7 – 8 тыс. кг/м3 (кроме благородных и редких). Оба определения условны и перечни тяжёлых металлов по этим формальным признакам не совпадают. И хотя термин «тяжёлые металлы» неудачен, им приходится пользоваться, так как он прочно вошел в экологическую литературу. Группа элементов, обозначаемых ТМ, активно участвует в биологических процессах, многие из них входят в состав ферментов. Набор тяжёлых металлов во многом совпадает с перечнем «микроэлементов». К микроэлементам относят химические элементы, облигатные (обязательные) для растительных и живых организмов (по А. П. Виноградову), содержание которых измеряется величинами порядка n ∙ 10-2 – n ∙ 10-5%. Также их называют «следовые», «малые», «редкие», «рассеянные» (В. И. Вернадский, Ф. Кларк, В. Гольдшмидт, А. Е. Ферсман). Большинство микроэлементов выполняет в живых организмах функции инициаторов и активаторов биохимических процессов. В число микроэлементов входят и многие неметаллы.
Районы, в которых концентрация химических элементов (соединений) в силу природных причин оказывается выше или ниже оптимального уровня, называют, по Виноградову, биогеохимическими провинциями. Формирование биогеохимических провинций обусловлено особенностями почвообразующих пород, почвообразовательного процесса, а также присутствием рудных аномалий. При загрязнении биосферы происходит образование техногенных аномалий, в которых содержание элементов превышает в 10 раз и более так называемое фоновое (или среднестатистическое содержание в незагрязненных ландшафтах). Техногенные геохимические аномалии подразделяют, по А. И. Перельману, на три типа:
§ глобальные, охватывающие весь земной шар;
§ региональные, охватывающие части материка, страны, области;
§ локальные, радиусом до нескольких десятков километров и связанные с определённым источником загрязнения.
К числу тяжёлых металлов относят хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьму, теллур, вольфрам, ртуть, таллий, свинец, висмут. Употребляемый иногда термин «токсические элементы» неудачен, так как любые элементы и их соединения могут стать токсичными для живых организмов при определённой концентрации и условиях окружающей среды.
Главным природным источником тяжёлых металлов являются породы (магматические и осадочные) и породообразующие минералы. Многие минералы в виде высокодисперсных частиц включаются в качестве акцессорных (микропримеси) в массу горных пород. Примером таких минералов являются минералы титана (брукит, ильменит, анатас), хрома (FeCr2O4). Породообразующие минералы содержат также рассеянные элементы в качестве изоморфных примесей в структуре кристаллических решеток, замещая макроэлементы с близким ионным радиусом. Так, К может быть замещён на Sr, Pb, B; Na – на Cd, Mn, Sr, Bi; Mg – на Ni, Co, Zn, Sb, Sn, Pb, Mn; Fe – на Cd, Mn, Sr, Bi (по В. А. Ковде, 1985). Многие элементы поступают в биосферу с космической и метеоритной пылью, с вулканическими газами, горячими источниками, газовыми струями.
Поступление тяжёлых металлов в биосферу вследствие техногенного рассеяния осуществляется разнообразными путями. Важнейшим из них является выброс при высокотемпературных процессах (черная и цветная металлургия, обжиг цементного сырья, сжигание минерального топлива). Кроме того, источником загрязнения биоценозов могут служить орошение водами с повышенным содержанием тяжелых металлов, внесение осадков бытовых сточных вод в почвы в качестве удобрения, вторичное загрязнение вследствие выноса тяжёлых металлов из отвалов рудников или металлургических предприятий водными или воздушными потоками, поступление больших количеств тяжёлых металлов при постоянном внесении высоких доз органических, минеральных удобрений и пестицидов, содержащих тяжёлые металлы (табл. 8).
Таблица 8. Сельскохозяйственные источники загрязнения почв различными элементами (по А. Кабата-Пендиас, Х. Пендиас)
| Элемент | Поступление поллютантов, мг/кг сухой массы | |||||
| при орошении сточными водами | с фосфатными удобрениями | с известью | с азотными удобрениями | с органическими удобрениями | с пестицидами, % | |
| As Cd Co Cr Cu F Hg Mn Mo Ni Pb Se Sn Zn | 2-26 2-1500 2-260 20-40 600 50-3300 2-740 0,1-55 60-3900 1-40 16-5300 50-3000 2-9 40-700 700-49 000 | 2-1200 0,1-170 1-12 66-245 1-300 8500-38 000 0,01-1,2 40-2000 0,1-60 7-38 7-225 0,5-25 3-19 50-1450 | 0,1-24,0 0,04-0,1 0,4-3,0 10-15 2-125 0,05 40-1200 0,1-15 10-20 20-1250 0,08-0,1 0,5-4,0 10-450 | 2,2-120 0,05-8,5 5,4-12 3,2-19 1-15 - 0,3-2,9 - 1-7 7-34 2-27 - 1,4-16,0 1-42 | 3-25 0,3-0,8 0,3-24 5,2-55 2-60 0,09-0,2 30-550 0,05-3 7,8-30 6,6-15 2,4 3,8 15-250 | 22-60 - - - 12-50 18-45 0,8-42 - - - - - 1,3-25 |
Фазовый состав тяжёлых металлов в промышленных выбросах, их дальнейшая трансформация. Несмотря на значительное разнообразие соединений тяжёлых металлов, поступающих в почву из окружающей среды, фазовый состав элементов в составе газопылевых выбросов предприятий цветной металлургии довольно однотипен – они представлены преимущественно оксидами. Количество сульфидов и водорастворимых фракций тяжёлых металлов сравнительно невелико (табл. 9).
Таблица 9. Фазовый состав соединений тяжёлых металлов в пыли, взятой с фильтров тонкой очистки свинцового завода (по В. С. Горбатову)
| Форма соединений | Zn | Pb | Cd | |||
| мг/г | % | мг/г | % | мг/г | % | |
| Общее содержание тяжёлых металлов В том числе в составе: оксидов сульфидов водорастворимой фракции остаток | 86,2 7,8 1,3 4,7 | 88,0 8,7 3,3 | 21,6 15,4 0,4 5,8 | 71,3 1,8 26,9 |
Первым этапом трансформации оксидов тяжёлых металлов в почвах является взаимодействие их с почвенным раствором и его компонентами. Даже в такой простой системе, как вода, находящаяся в равновесии с СО2 атмосферного воздуха, оксиды тяжёлых металлов подвергаются изменениям и существенно различаются по своей устойчивости. Оксид цинка – наиболее стабилен и менее растворим по сравнению с оксидами свинца и кадмия. Его растворимость в диапазоне pH 4 – 8 более чем в 100 раз ниже, чем растворимость PbO, и почти в 10 000 раз ниже CdO. В отличие от оксида цинка оксиды свинца и кадмия неустойчивы в воде и преобразуются в гидроксид и (или) карбонат (гидроксокарбонат) свинца и карбонат кадмия.
Парциальное давление СО2 в почвенном воздухе во много раз превышает таковое в атмосфере и поэтому в почве преобладают более устойчивые гидроксокарбонаты и карбонаты цинка и свинца. Следующими реакциями после растворения неустойчивых оксидов являются катионный обмен и специфическая адсорбция. Реакции адсорбции и катионного обмена могут быть описаны уравнениями Фрейндлиха, Ленгмюра и закона действующих масс.
Ионы тяжёлых металлов способны специфически адсорбироваться почвами с образованием относительно прочных связей координационного типа с некоторыми поверхностными функциональными группами. Так, при взаимодействии ионов тяжёлых металлов с поверхностными ОН-группами алюмосиликатов или гидроксида алюминия возможно образование следующих соединений:
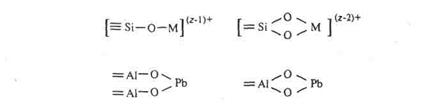
где Мz+ - ион металла.
Специфическая адсорбция более избирательна, чем неспецифическая, и зависит как от свойств сорбируемых ионов, так и от природы поверхностных функциональных групп, поэтому тяжёлые металлы энергично адсорбируются почвами из растворов. Механизм специфического поглощения более свойствен свинцу, чем цинку и кадмию. Коэффициенты селективности, рассчитанные для обменной реакции катионов тяжёлых металлов с поглощённым кальцием, подтверждают преимущественное поглощение тяжёлых металлов по сравнению с кальцием, а в ряду тяжёлых металлов селективность адсорбции свинца более чем в 1000 раз выше, чем цинка и кадмия (табл. 10). Таким образом, процесс трансформации поступивших в почву в процессе техногенеза тяжёлых металлов включает следующие стадии:
- преобразование оксидов тяжёлых металлов в гидроксиды (карбонаты, гидрокарбонаты);
- растворение гидроксидов (карбонатов, гидрокарбонатов) тяжёлых металлов и адсорбция соответствующих катионов тяжёлых металлов твердыми фазами почвы;
- образование фосфатов тяжёлых металлов и их соединений с органическими веществами почвы.
Таблица 10. Коэффициенты селективности (К) пар катионов «тяжёлый металл – Ca2+» (по В. С. Горбатову)
| Концентрация тяжёлых металлов, мкг/мл | K(Zn - Ca) | K(Cd – Ca) | K(Pb - Ca) |
| 7,5 4,6 3,9 1,4 0,75 - - - | 6,5 3,9 3,4 1,4 0,84 - - - | - - - 2,7 |
Железо. Железо, по геохимической классификации Гольдшмидта, относится к числу сидерофильных элементов (типичных металлов), имеющих химическое сродство к углероду (с образованием карбонатов), к фосфору (фосфатов), к сере и кремнию (сульфатов, сульфидов, силикатов). Помимо железа к сидерофильным элементам относят кобальт, никель, молибден, технеций, рутений, родий, осмий, иридий, платину.
При окислительном выветривании и почвообразовании образуются и накапливаются в биосфере минералы железа (III), преимущественно оксиды и гидроксиды, слаборастворимые и геохимически относительно инертные. В почвах обнаружены многие минералы железа (II) и железа (III), в том числе оксиды: гематит Fe2O3, магнетит FeO ∙ Fe2O3; маггемит Fe2O3; гидроксиды: гетит FeOOH, лимонит 2Fe2O3 ∙ 3H2O; сульфиды; кислые железистые минералы: ярозит [NaKFe6(OH)12(SO4)4], феронатрит [Na3Fe(SO4)3 ∙ 3H2O], фосфаты, силикаты, арсенаты железа, органожелезистые соединения, аморфные осадки гидроксидов.
Различные соединения железа играют существенную и весьма сложную роль в почвенных процессах в связи со способностью элемента менять степень окисления с образованием соединений различной растворимости, окисленности, подвижности. Железо в очень высокой степени вовлечено в антропогенную деятельность, оно отличается настолько высокой технофильностью, что нередко говорят о современном «ожелезнении» биосферы. В техносферу в процессе антропогенной деятельности вовлечено более 10 млрд. т железа, 60% которого рассеяно в пространстве.
Почвенно-геохимическая судьба соединений железа обусловлена кислотно-основными, окислительно-восстановительными условиями, аэрированностью и увлажненностью почвы, микробиологической активностью. Восстановление железа (и марганца) происходит при окислительно-восстановительном потенциале Eh ниже + 300 мВ. В автоморфных почвах, как правило, преобладают соединения железа (III) при значениях Eh около + 400 - + 650 мВ; в гидроморфных почвах, если Eh опускается до + 300 мВ, представлены либо обе формы железа, либо железо (II).
Биогеохимический цикл соединений железа и марганца представляется следующим. Выветривание и почвообразование сопровождаются десиликацией пород и потерей оснований, окислением соединений железа и марганца, образованием осадков оксидов и гидроксидов, относительным обогащением элювия полуторными оксидами.
Во влажных субтропиках образуются кислые коры выветривания (краснозёмы, бокситы), обогащённые окисленными соединениями железа, марганца, а также титана и алюминия. В холодных гумидных ландшафтах соединения железа и марганца накапливаются лишь частично в иллювиальных горизонтах, в кислых бурых почвах, образуя нередко локальные скопления в форме кутан, ортштейнов, ортзандов. Эрозия и переотложение мелкоземного материала, содержащего оксиды и гидроксиды железа, приводят к образованию склонового делювия, пролювия, аллювия, формированию ферраллитных и аллитных почв, обогащённых оксидами и гидроксидами железа, алюминия, марганца. Этот процесс осложняется растущей кислотностью среды, наличием органического вещества, анаэробиозом, деятельностью микроорганизмов. При развитии восстановительных процессов активизируется геохимическая миграция железа и марганца в виде хелатных соединений, гидрокарбонатов, сульфатов.
С водными потоками геохимически активные соединения железа, марганца интенсивно мигрируют, но при смене теплового, окислительно-восстановительного, кислотно-основного режимов, минерализации органического вещества (иными словами, при прохождении потоков через геохимические барьеры) соединения железа и марганца осаждаются и аккумулируются как в транзитных, так и в аккумулятивных ландшафтах. Выветривание, переувлажнение, кислотно-анаэробное почвообразование способствуют постоянному пополнению подвижных соединений железа и марганца в количестве до 800 - 820 кг/(га ∙ год).
Аэрация восстановленных горизонтов почвы, различных отвалов, терриконов приводит к реакциям окисления; при этом присутствующие в таких материалах сульфиды железа преобразуются в сульфаты железа с одновременным образованием серной кислоты:
4FeS2 + 6H2O + 15O2 = 4FeSO4(OH) + 4H2SO4
В таких средах значения рН могут опускаться до 2,5 – 3,0. Серная кислота разрушает карбонаты с образованием гипса, сульфатов магния и натрия. Периодическая смена окислительно-восстановительных условий среды приводит к декарбонизации почв, дальнейшему развитию устойчивой кислой среды с рН 4 – 2,5, причём соединения железа и марганца накапливаются в поверхностных горизонтах.
Гидроксиды и оксиды железа, марганца при образовании осадков легко захватывают и связывают никель, кобальт, медь, хром, ванадий, мышьяк. Мелиоративные мероприятия изменяют условия миграции железа и марганца.
Свинец. В IV группе периодической системы особое значение имеет свинец вследствие высокой токсичности его соединений. Свинец ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их. Присутствие повышенных концентраций свинца в воздухе и продуктах питания представляет угрозу для здоровья человека.
В характерных для биосферы условиях свинец представлен соединениями со степенями окисления свинца + 2 и + 4 (оксид PbO и диоксид свинца PbO2). Более устойчивы и распространены в природе соединения Pb (II). Попадающий при химическом загрязнении в почву свинец сравнительно легко образует гидроксид при нейтральной или щелочной реакции. Если почва содержит растворимые фосфаты, тогда Pb(OH)2 переходит постепенно в Pb3(PO4)2 или другие труднорастворимые фосфаты. Растворимость соединений свинца в диапазоне рН 8,5 – 11,0 и в восстановительных условиях при рН 2 низкая – менее 1 мг/л; в интервале рН 6 – 8 растворимость элемента является сложной функцией рН, концентрации СО2 и соединений серы в воде.
Мировое производство свинца составляет 34 ∙ 106 т в год и постоянно возрастает, причем выбросы свинца в атмосферу достигают 4,3 ∙ 106 т в год и его антропогенное поступление значительно превышает природное. При сжигании нефти и бензина в окружающую среду поступает не менее 50% всего антропогенного свинца, что является важной составляющей в глобальном цикле элемента. Автомобильные выхлопы дают около 50% общего неорганического свинца, попадающего в организм человека. Другим важным источником антропогенного поступления свинца в окружающую среду является производство черных и цветных металлов, а также горнодобывающая промышленность. Существенное значение, особенно для морских и пресноводных систем, имеют атмосферные выбросы соединений Pb.
Показатель технофильности свинца очень высокий и уступает лишь углероду, хлору и золоту. Добыча, переработка, выплавка металла сопровождаются рассеиванием свинца в биосфере, причем часто в более активной, миграционноспособной форме, чем его природные соединения. Большая часть элемента находится в природе в рассеянном состоянии; он входит в состав более чем 200 минералов, и только три из них образуют промышленные запасы элемента: галенит PbS, англезит PbSO4, церрусит PbCO3. Свинец входит в состав многих породообразующих минералов. Так, в калиевых полевых шпатах (ортоклаз и микроклин) содержится от 10 до 280 мг/кг свинца.
Ртуть. В соединениях ртуть может быть как двухзарядной, так и формально однозарядной; она характеризуется высоким потенциалом ионизации и окислительным потенциалом, является химически стойким элементом. Одной из главных особенностей иона ртути является способность к образованию комплексных соединений с координационными числами от 2 до 8. Связь ртуть – лиганд во всех комплексах является ковалентной. Наиболее устойчивы комплексы с лигандами, содержащими атомы галогенов, углерода, азота, фосфора, серы. Ртуть образует также значительное число комплексов с органическими реагентами, характеризующихся высокой прочностью (8-меркаптохинолин, тиомочевина). Известны и ртутьорганические соединения типа RHgX или R2Hg, обнаруженные в последнее время в различных компонентах биосферы – донных осадках, природных водах.
Ртуть встречается в природе как в самородном состоянии, так и в соединениях, образуя ртутные минералы: киноварь HgS, тиманит HgSe, ливингстонит HgS ∙ 2Sb2S3, монтроидит HgO. Ртуть входит в качестве изоморфной или механической примеси в реальгар, антимонит, молибденит, пирит, пирротин, сфалерит. Среднее содержание ртути в каменном угле составляет 1 ∙ 10 -6 %.
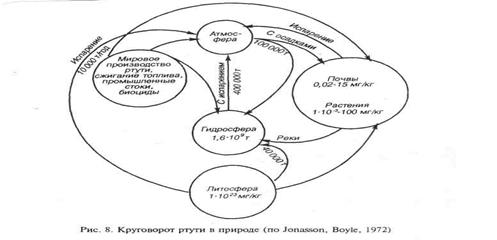
За геологическое время в биосферу в результате природных процессов (вулканическая деятельность, фумаролы) поступило около 1,6 ∙ 1010 т ртути. Около 0,1% от этого количества остается в океанах в растворённом виде. Количество ртути, поступившее в окружающую среду в текущем столетии в результате антропогенной деятельности, почти в 10 раз превышает природное поступление и составляет 57 000 т. Круговорот ртути в природе представлен на рис. 2.
Хром. Хром отличается широким разнообразием состояний окисления (от + 2 до + 6) и способностью образовывать комплексные анионы и катионы, например Cr(OH) 2+, CrO4 2-, CrO3 -. В природных соединениях он имеет степени окисления + 3 и + 6. Высокоокисленные формы хрома менее устойчивы, чем Cr 3+.
Главными источниками хрома в биосфере являются промышленные отходы (гальванические осадки, отходы кожевенных заводов и производств, где хром входит в состав пигментов и красителей), осадки сточных вод. Другими, менее важными, источниками загрязнения хромом являются воды из циркуляционных систем охлаждения, производства клея, средств для стирки белья. Источниками загрязнения являются также жидкие стоки кожевенных производств, красилен, отвалы шлаков при производстве феррохрома, хромовых сталей; некоторые фосфорные удобрения содержат хрома до 102 – 104 мг/кг.
Поступающий из антропогенных источников Cr 6+ в пресных водах восстанавливается до Cr 3+, а затем сорбируется взвесью и донными осадками. Поступление бытовых стоков в реки вызывает резкое падение содержания растворенного кислорода и образование сероводорода. Это в 2,5 – 3 раза снижает долю Cr 6+ от общего содержания хрома в растворе.
Поскольку хром (III) в кислой среде инертен (выпадая почти полностью в осадок при рН 5,5), его соединения в почве весьма стабильны. Напротив, хром (VI) крайне нестабилен и легко мобилизуется в кислых и щелочных почвах. Снижение подвижности хрома в почвах может приводить к его дефициту в растениях.
Установлено, что известкование, а также применение органических веществ и соединений фосфора существенно снижает токсичность хроматов в загрязненных почвах. При загрязнении почв хромом (VI) подкисление, а затем применение восстанавливающих агентов (например, серы) используется для восстановления его до хрома (III), после чего проводится известкование для осаждения соединений Cr (III).
Поведение хрома зависит как от рН, так и от окислительно-восстановительного потенциала. Так, при одном и том же значении Eh = 500 мВ в интервале рН > 5 – 7 преобладает Cr (III), а при рН 7 – Cr (VI). На поведение хрома существенное влияние оказывают органические вещества.
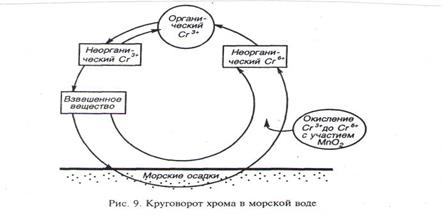
Биогеохимические циклы хрома подробно изучены на примере экосистем пресных и соленых водоемов. Два главных окислительных состояния хрома в природных водах – это Cr 3+ и Cr 6+. В кислородсодержащих водах термодинамически устойчив Cr 6+. Однако Cr 3+ благодаря кинетической стабильности может присутствовать в связанной с твердыми частицами форме. Условия взаимного перехода Cr 3+ и Cr 6+ близки к условиям природных вод. Cr 6+ легко восстанавливается в присутствии Fe 2+, растворенных сульфидов и некоторых органических веществ, содержащих SH – группы. Cr 3+, напротив, быстро окисляется лишь при большом избытке MnO2 и медленно – кислородом в условиях природных вод.
Исследования форм нахождения хрома в Тихом океане и Японском море показали, что хром присутствовал на 10 – 20% в неорганической форме Cr 3+, на 25 – 40% в форме Cr 6+ и на 45 – 65% в органических формах. Соотношения растворенной и взвешенной форм были 0,42:0,07 мкг/л (Тихий океан) и 0,42:0,08 мкг/л (Японское море). Однако вертикальное распределение Cr 6+ в этих двух бассейнах оказалось различным: в Тихом океане концентрация хрома Cr 6+ росла на глубине ≥ 1000 м, а в Японском море убывала. Отношение Cr 6+/ Cr 3+неорг. было около 2,7 в Тихом океане и 1,8 в Японском море. Это различие связано с присутствием сильного окислителя – диоксида марганца на больших глубинах в Тихом океане и отсутствием его в Японском море. Для круговорота хрома в морской воде предложена модель, изображенная на рис. 3.
Случаев значительного загрязнения хромом поверхностных вод зафиксировано немного. Концентрации растворенного хрома в незагрязненных озерах и реках обычно колеблются в пределах 1 – 2 мкг/л, а в океане – 0,05 – 0,5 мкг/л. Более высокие значения (5 – 50 мкг/л) были обнаружены в некоторых крупных реках, протекающих через индустриальные районы. Это обычно связано со сбросами в них стоков крупных промышленных предприятий.
Установлено повышение уровня содержания хрома в донных осадках за счёт антропогенных источников. Обогащение осадков коррелирует с источником поступления золы – от сжигания нефти, угля и древесины.
Относительно высокая скорость осаждения хрома в городах ведёт к существенному загрязнению почв. Например, в Копенгагене (Дания) среднее содержание хрома в почве составляет 85 мг/кг, тогда как в штате Нью-Джерси (США) – 9,3 мг/кг. Высокая скорость поступления хрома в городах связана с повышенными концентрациями его в дождевых и поверхностных водах (27 мкг/л).
Пестициды
Пестициды применяются в различных формах: растворы, суспензии, аэрозоли, пены, газы, пары, пыль, порошки, пасты, гранулы, капсулы. Наиболее удобным и сравнительно безопасным является внесение их в почву в виде гранул и капсул, растворяющихся при определённой влажности и реакции среды почвенного раствора. Самую обширную группу пестицидов как по масштабам применения (40 – 50%), так и по ассортименту выпускаемых препаратов (около 40%) составляют гербициды, т.е. средства борьбы с сорняками.
По характеру действия гербициды можно подразделить на две подгруппы:
1. сплошные, действующие на все виды растений и использующиеся для уничтожения нежелательной растительности вокруг промышленных предприятий, на обочинах дорог, лесных вырубках, в каналах и водоёмах и т.п.;
2. избирательные (селективные), опасные для определённых видов растительности и используемые для уничтожения сорняков в агроценозах.
Деление это до некоторой степени условно: в зависимости от концентрации препарата и норм расхода одни и те же ядохимикаты могут проявлять себя и как избирательные, и как сплошные гербициды.
Попадание пестицидов в атмосферу осуществляется непосредственно при их использовании в виде газов, паров, аэрозолей или при распылении любых форм пестицидов с самолёта. С воздушными массами они могут переноситься на большие расстояния и вызывать загрязнение окружающей среды там, где пестициды вообще не применялись или использовались в меньших количествах.
При внесении в почву пестициды подвергаются многочисленным влияниям биотического и небиотического характера, которые определяют их дальнейшее поведение, трансформацию и в конечном счёте минерализацию. Направление и скорость превращения молекул пестицидов обусловлены химической природой действующего вещества, типом почвы, состоянием и активностью ее биоты, характером внешних воздействий на почвенный покров (агротехнические и мелиоративные приемы и т.п.).
Хлорорганические инсектициды – гексахлоран, ДДТ и др. – обычно слаборастворимы в воде, очень устойчивы ко всем видам разложения и могут сохраняться в почве десятилетиями, аккумулируясь при систематическом применении.
Фосфорорганические инсектициды (карбофос, фосфамид, метафос, амифос и др.) в почве и других природных средах распадаются сравнительно быстро. При этом они отличаются высокой эффективностью и избирательностью действия и их применение весьма перспективно.
Широко используются в современном сельском хозяйстве и карбаматные инсектициды, представляющие собой сложные эфиры карбаминовой кислоты. Отличаясь высокой токсичностью для отдельных видов насекомых, эти препараты почти полностью безвредны для теплокровных позвоночных и человека.
Некоторые пестициды представлены в табл. 11.
Таблица 11. Области применения некоторых пестицидов
| Промышленное наименование | Химическое наименование | Назначение |
| Фосфорорганические препараты | ||
| Карбофос (мелат-ион) | О, О-Диметил-S-(1,2- дикарбоэтоксиэтил)дитиофосфат | Уничтожение вредителей фруктовых деревьев, овощей, декоративных растений |
| Дихлорофос | О, О-Диметил- О-фат(2,2- ихлорвинилфосфат) | Уничтожение домашних насекомых |
| Диазинон | О, О-Диэтил- О-(2-изопро-пил-4-метилпирамидил-6)-тиофосфат (IV) | Уничтожение многих вредителей овощей и фруктовых деревьев |
| Производные карбаматов | ||
| Севин | 1-Нафтил-N-метилкарбамат | Обработка хлопчатника, кормовых культур, фруктов и овощей |
| Производные хлорфеноксикислот | ||
| 2,4-Д | 2,4-Дихлорфеноксиуксусная кислота | Уничтожение растительности в водных системах; дефолиант |
| 2,4-ДМ | 2,4-Дихлорфенокси-y-масля-ная кислота | Уничтожение растительности на обочинах дорог и в водоёмах |
Все пестициды являются ядовитыми веществами не только для определённой формы жизни, но и для полезных насекомых и микроорганизмов, животных, птиц и человека. В идеальном случае пестицид, оказав требуемое воздействие на вредителя, должен был бы сразу разрушиться, образовав безвредные продукты разложения. Однако большинство пестицидов представляют собой устойчивые трудноразлагаемые соединения, у которых непосредственно используется 4 – 5% внесенного количества, а остальная масса рассеивается в агроэкосистеме, попадая в почву, растения и другие компоненты окружающей среды, что создает сложные экологические проблемы.
В зависимости от способности сопротивляться процессам разложения пестициды подразделяют на слабостойкие (сохраняются в окружающей среде 1 – 12 недель), среднестойкие (сохраняются 1 – 18 месяцев) и очень стойкие (сохраняются два года и более). Очевидно, что слабостойкие пестициды в окружающей среде практически не накапливаются.
Под устойчивостью пестицида понимают его способность определённое время сохраняться в почвах, измеряемую периодом полураспада, т.е. временем, необходимым для разрушения 50% внесенного в почву пестицида (табл. 12).
Таблица 12. Период полураспада хлорорганических инсектицидов в почве
| Инсектицид | Период полураспада, годы | Инсектицид | Период полураспада, годы |
| Гептахлор Изодрин, эндрин Токсафен Альдрин | 7 – 12 4 – 8 1 – 4 | Дильдрин Хлоран ГХЦГ | 1 – 7 2 – 4 |
Серосодержащие пестициды разлагаются за счёт окислительно-восстановительных реакций; разложение ряда пестицидов связано с присутствием в почве свободных радикалов (разложение амитрола) или избытка нитратов (переход атразина в N-нитроатразин). Однако преобладающую роль в разложении пестицидов играют почвенные микроорганизмы.
Продолжительность биотического разложения пестицидов может колебаться от нескольких дней до нескольких месяцев и даже десятков лет. Фосфорорганические соединения и производные карбамидной кислоты разлагаются сравнительно быстро, менее чем за 5 месяцев, и даже при больших масштабах использования не образуют токсичных метаболитов. Напротив, срок разложения хлорорганических соединений может достигать 2 – 3 лет, а в ряде случаев 10 лет и более.
Наблюдения показывают, что в течение первого года после внесения 80 – 100% хлорорганических биоцидов сохраняется в почве и лишь мигрирует вниз по почвенному профилю. Более того, некоторые препараты этого типа под воздействием почвенных микроорганизмов активируются: так, 2,4-дихлорфеноксимасляная кислота преобразуется в известный гербицид 2,4-Д, обладающий гораздо более сильными фитотоксичными свойствами. Рядом исследований установлено, что хлорорганические инсектициды (альдрин, дильдрин, линдан, гептахлор) медленно разлагаются в хорошо аэрированных почвах и активно – в почвах с недостатком кислорода, т.е. в анаэробных условиях. Поэтому для ускорения разложения остаточных количеств некоторых инсектицидов в почвах нередко используют затопление.
Почва явл
Дата добавления: 2017-04-05; просмотров: 5069;











