Тема 2. Антигены. Антитела(строение, классификация, идиотипические различия).
АНТИГЕНЫ
Антиген (от англ. antibody generator) молекулы способные индуцировать образование антител В-лимфоцитами или же связываться с антиген распознающими рецепторами Т-лимфоцитов, после чего запускается иммунный ответ.
(По другому антиген называютиммуногеном,т.е. фактором вызывающий иммунные реакции).
Участки молекулы антигена которые непосредственно связываются с антителами называют эпитопом(ранее известные как антигенные детерминанты)
Один антиген может иметь несколько различных или повторяющихся эпитопов.
Антитела специфичны не ко всей молекуле антигена а только к эпитопам,.
В распознавании антигенов участвуют, помимо свободно циркулирующих антител и антитела фиксированные на мембранах В-клеток.
Т-клетки с помощью своих мембранных рецепторов распознают антигены в виде полипептидных фрагментов, представленных на поверхности клеток организма.
Антитела и Т-клеточные рецепторы не всей поверхностью связываются с эпитопами антигенов.
Участки связывания рецепторов антител с эпитопами назвают паратопами.
Одни антигены вызывают стойкую невосприимчивость организма при повторном контакте с микробными телами, т.е. иммунитет.
В отличии от них некоторые антигены вызывают не защитные, а аллергические реакции, поэтому и называются аллергенами.
Гаптеныэтонеполноценные антигены.
Способностью вызывать образование антител они не обладают, при этом сохраняют способность связываться с ними.
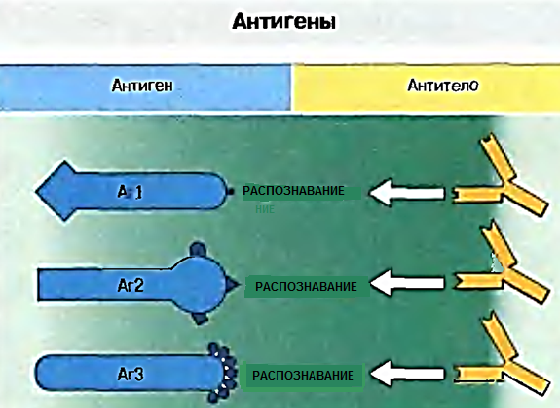
|
| Каждая молекула антигена имеет набор антигенных детерминант, называемых эпитопами. Эпитопы одного антигена (Аг1) обычно отличаются от эпитопов другого (Аг2). Некоторые антигены (АгЗ) имеют повторяющиеся эпитопы. Стереохимическая конфигурация эпитопов распознается антителами и Т-клеточными рецепторами. Каждая молекула антитела распознает не всю молекулу антигена, а один ее эпитоп. Даже самые простые по строению микроорганизмы обладают множеством различных антигенов белковой, липидной или углеводной природы. А. Ройт и др. ИММУНОЛОГИЯ, «Мир», 2000 |
АНТИТЕЛА
Основная функция специфического иммунного ответа — это специфическое распознавание чужеродных антигенов.
В распознавании участвуют молекулы двух разных типов — иммуноглобулины и Т-клеточные рецепторы антигенов (ТкР).
Иммуноглобулины представляют собой группу гликопротеинов, которые содержатся в плазме крови и в тканевой жидкости у всех млекопитающих.
Некоторые иммуноглобулиновые молекулы структурно связаны с плазматической мембраной В-клеток и функционируют как антиген-специфичные рецепторы.
Другие (антитела) присутствуют в плазме или в лимфе как свободные молекулы.
Синтез антител осуществляют В-клетки, но для этого необходим контакт с антигеном и вызванное им созревание В-клеток в антителообразующие клетки, т.е. плазматические клетки.
У большинства высших млекопитающих обнаружено пять классов иммуноглобулинов — IgG, IgA, IgM, IgD и IgE, которые различаются по размерам молекул, заряду, аминокислотному составу и содержанию углеводов.
Каждый иммуноглобулин выполняет две функции.
Одна область его молекулы предназначена для связывания с антигеном, другая осуществляет так называемые эффекторные функции.
К ним относится связывание иммуноглобулина с тканями организма, различными клетками иммунной системы, определенными фагоцитарными клетками и первым компонентом комплемента (Clq) при активации этой системы по классическому пути.
Основная структурная единица иммуноглобулина любого класса состоит из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, удерживаемых вместе дисульфидными связями .
От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу и подклассу.
Так, у человека четыре подкласса IgG (lgGl, lgG2, lgG3 и IgG4) имеют тяжелые γ(гамма)цепи соответственно γl, γ2, γЗ и γ4; все они выявляются иммунохимически как γ-цепи, но незначительно отличаются друг от друга.
Известны также два подкласса IgA (IgAl и lgA2) соответствующими тяжелыми α(альфа) цепями α1 и α2.
Подклассов IgM, IgD и IgE человека пока не обнаружено.
IgG.Молекула IgG представляет собой четырех цепочечный мономер.
Иммуноглобулины класса G составляют большинство антител вторичного иммунного ответа, а также основную часть антитоксинов.
Кроме того, именно (материнские) IgG обеспечивают невосприимчивость ребенка к инфекциям в первые несколько месяцев жизни.
У человека антитела всех подклассов IgG проникают через плаценту в организм плода, создавая напряженный пассивный иммунитет на весь неона-тальный период.
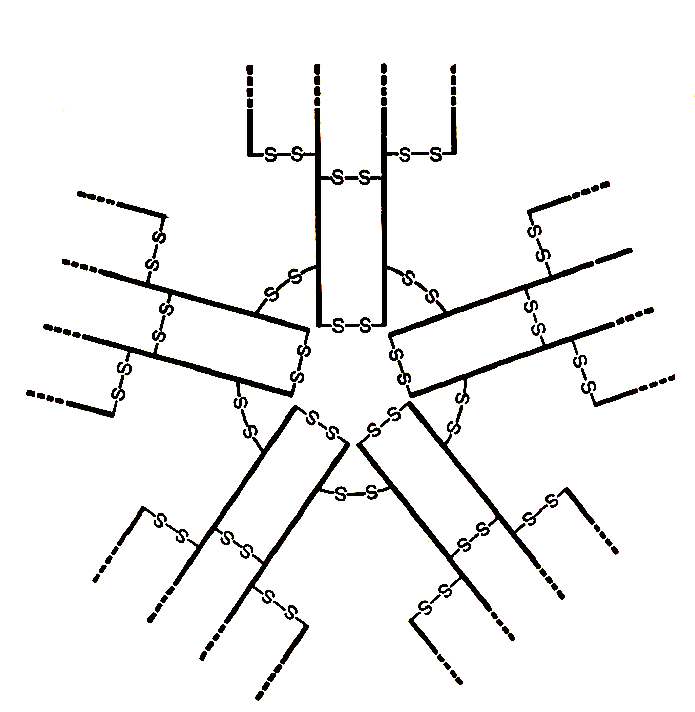
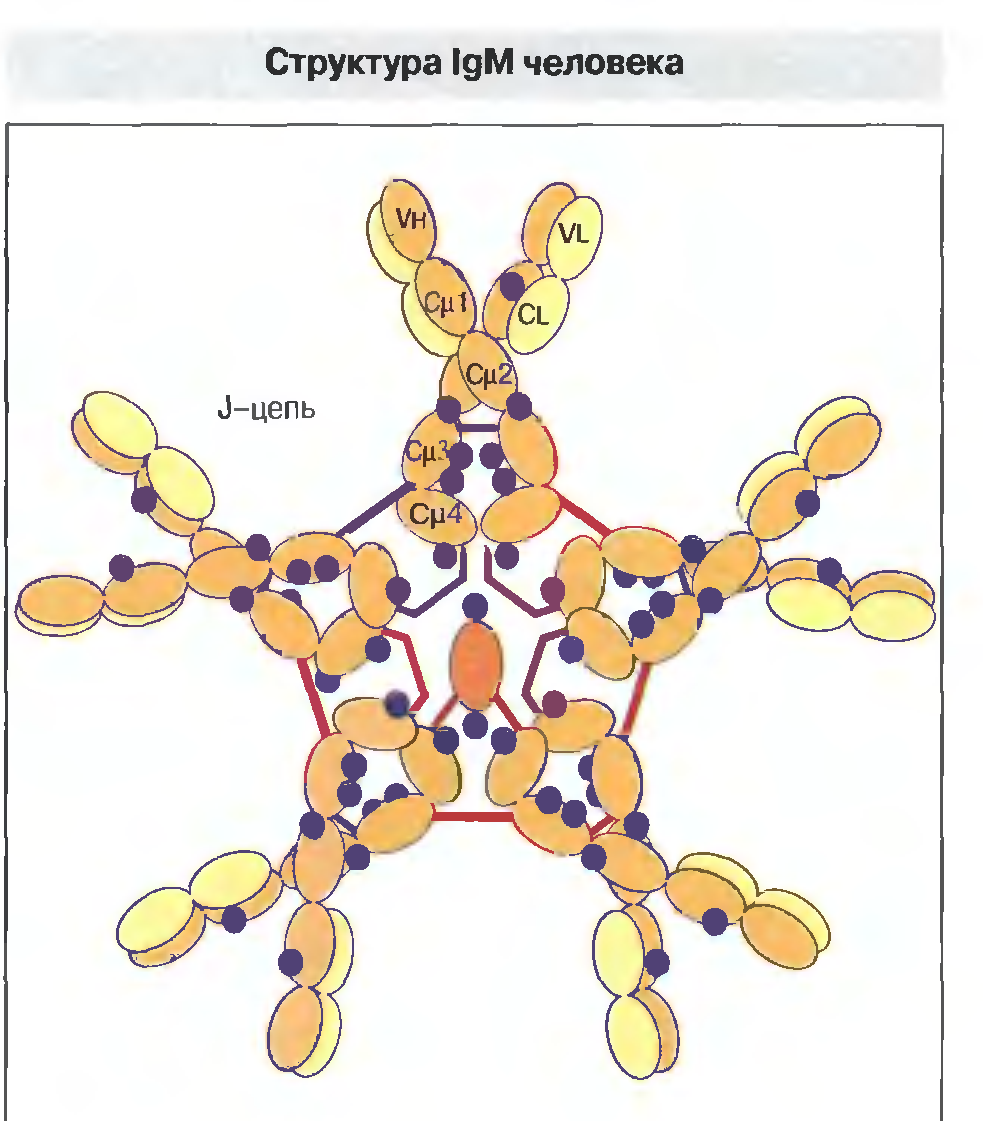
IgM.Молекула IgM представляет собой пентамер основной четырехцепочечной единицы.
Антитела этого класса содержатся преимущественно во внутрисосудистом пуле иммуноглобулинов и доминируют в качестве «ранних» антител, чаще всего при иммунном ответе на сложные по антигенному составу патогенные микроорганизмы.
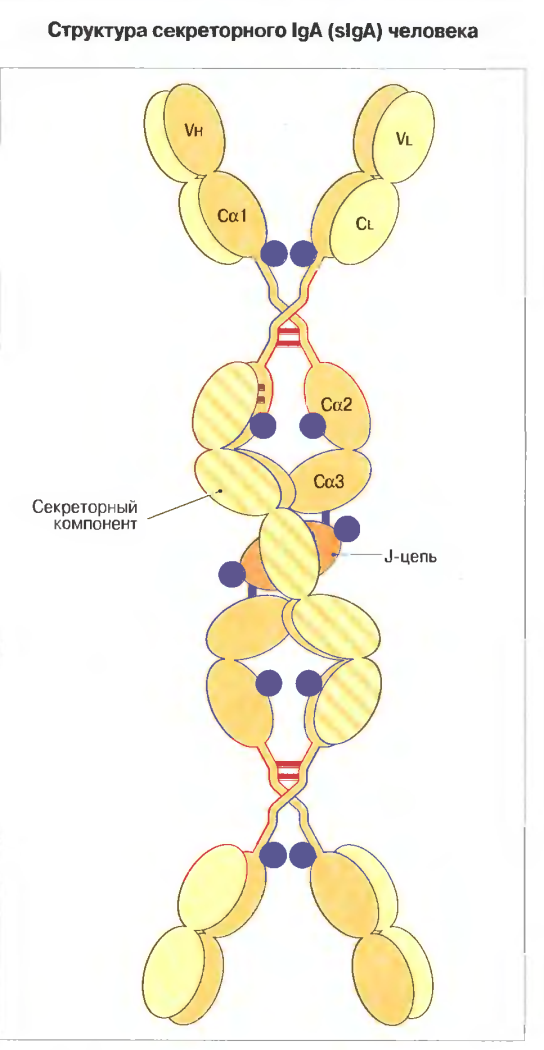
IgA. Белки этого класса представлены в виде мономера — четырехцепочечной единицы.
Однако в сыворотке большинства других млекопитающих IgA присутствует большей частью в полимерной форме, чаще всего как димер четырехцепочечной единицы.
IgA — это главный класс иммуноглобулинов серозно-слизистых секретов, таких как слюна, молозиво и молоко, а также отделяемого слизистой оболочки дыхательных и мочеполовых путей.
Секреторные IgA (slgA) относятся к подклассу IgAl или lgA2 и представлены в основном димерной формой.
Они присутствуют в большом количестве в серозно-слизистых секретах, где связаны с другим белком, называемым секреторным компонентом.
IgD.Этот класс представлен на мембране многих В-клеток.
Биологическая роль данного класса иммуноглобулинов до конца не известна. Предположительно он участвует в антиген-зависимой дифференцировке лимфоцитов.
IgE. Концентрация этого класса иммуноглобулинов в сыворотке ничтожномала, но он выявляется на поверхностной мембране базофилов и тучных клеток у любого человека.
Кроме того, IgE сенсибилизированы клетки слизистых оболочек, в частности носовой полости, бронхов и конъюнктивы.
Возможно, IgE имеют существенное значение в ангигельминтозном иммунитете, однако в развитых странах с ними чаще всего связан патогенез аллергических заболеваний, например бронхиальной астмы и сенной лихорадки.
СТРОЕНИЕ АНТИТЕЛ
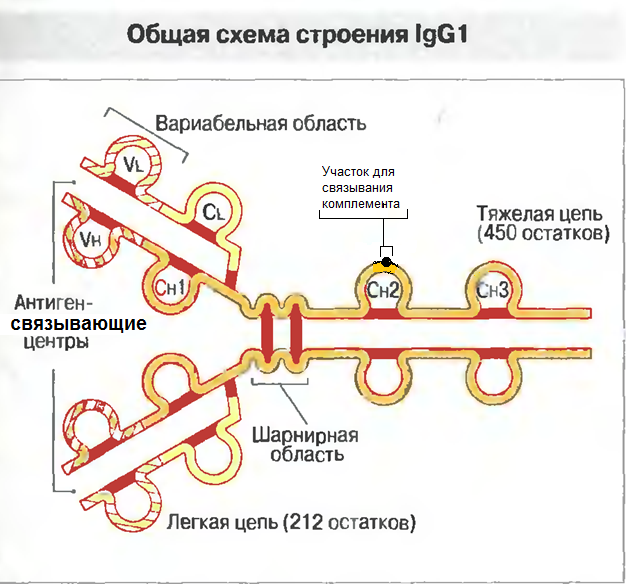
Основная четырехцепочечная структурная единица (мономер) иммуноглобулиновых молекул образована полипептидными цепями двух разных типов. Меньшие по размерам (легкие. L — от англ. light) цепи одинаковы у всех классов, тогда как более крупные (тяжелые, Н — от англ. heavy) цепи структурно различны у разных классов и подклассов иммуноглобулинов.
Полипептидные цепи удерживаются вместе ковалентными и нековалентными связями.
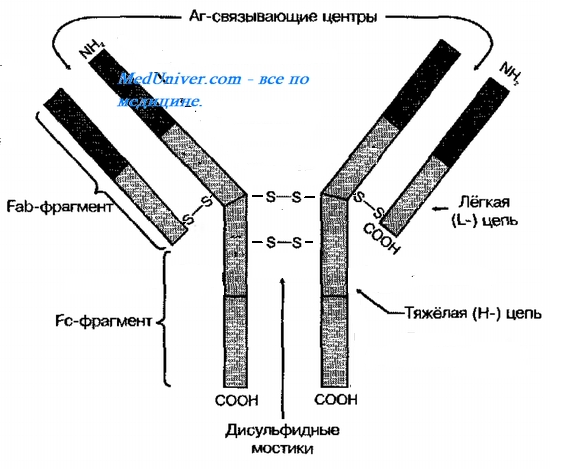
|
Легкие цепи существуют в двух различных изотопических формах, обозначенных каппа (κ) и лямбда (λ).
В молекуле иммуноглобулина могут объединяться пары легких и тяжелых цепей любого типа, но обе цепи в паре относятся к одному типу.
Легкие цепи состоят из двух различных областей.
С-концевая половина цепи одинакова (константна) у легких цепей всех типов (исключая некоторые аллотипические и изотипические варианты); она названа константной, или CL-областью (от англ. constant light chain).
В то же время N-концевая половина этой цепи имеет множество вариантов аминокислотной последовательности, из-за чего названа вариабельной, или VL-областью (от variable light chain).
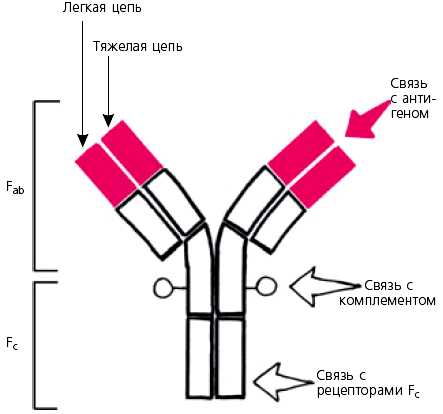
В качестве «типичного» антитела можно рассматривать молекулу IgG.
В ней имеется две внутрицепочечные дисульфидные связи в каждой легкой цепи — по одной в вариабельной и константной областях — и четыре таких связи в каждой тяжелой (γ)цепи, которая вдвое длиннее легкой.
Каждая дисульфидная связь замыкает пептидную петлю(домен) из 60—70 аминокислотных остатков;
при сравнении аминокислотных последовательностей этих петель выявляется высокая степень их гомологии.
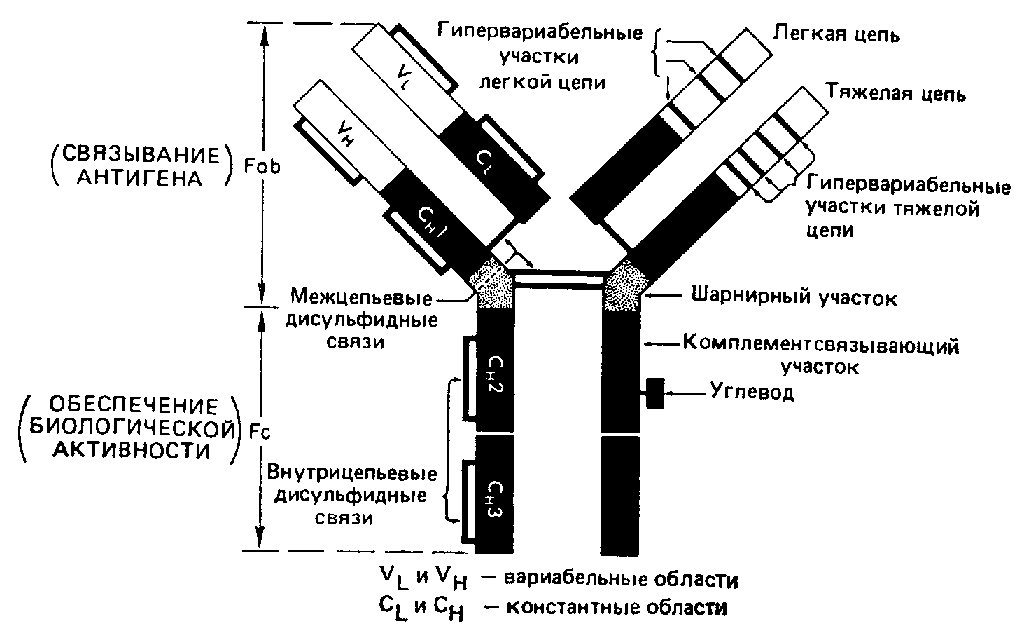
Каждая полипептидная цепь иммуноглобулина образует несколько глобулярных доменов с весьма сходной вторичной и третичной структурой.
Как в легких, так и в тяжелых цепях первые от N-конца домены образованы соответственно вариабельными областями Vl и Vh.
Тяжелые цепи IgG, IgA н IgD имеют еще три домена — Сн1, Сн2 и Сн3, составляющих константную область.
В тяжелых цепях иммуноглобулинов классов M и Е (соответственно μ– мю и ε- эпсилон) непосредственно за СH3 следует один дополнительный домен - СH4 , поэтому С-концевые домены тяжелых цепей IgM и IgE (обозначаемые Сμ 4 и Сε4) гомологичны СнЗ-домену IgG (СγЗ).
С антигенами антитела связываются активным центром или Fab-фрагментом (antigen binding).
Fab-фрагменты образуются вариабельными доменами тяжелых и легких цепей.
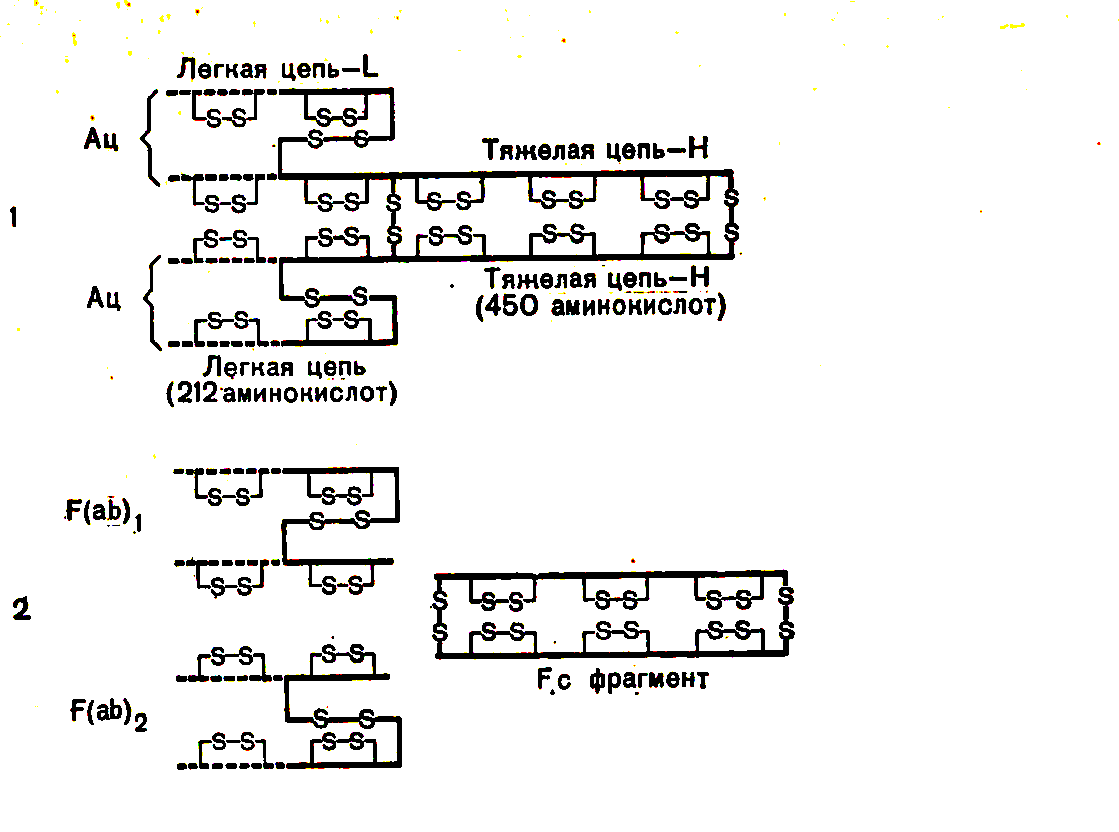
Иммуноглобулины классов G, D и E имеют по 2 таких центра, димер IgА по 4 и пентамер IgМ по 10.
Каждый Fab-фрагмент несет один активный центр, т. е. является моновлентным, и, связываясь с антигеном, не приводит к образованию конгломератов.
В активноим центре (VL и VH) имеются от 4 до 8 аминокислотных остатков, которые относятся к так называемым гипервариабельным областям легких и тяжелых цепей.
Таких областей в вариабельных участках тяжелых цепей четыре.
Они обозначаются как Hhv 1—4.
В легких цепях гиперварпабельных областей 3(Lhv 1—3).
Понятие гипервариабельности возникло при сравнении последовательности аминокислот в тяжелых или в легких полипептидных цепях, изолированных из иммуноглобулинов различных индивидуумов.
Оказалось, что в некоторых регионах вариабельных участков несовпадения аминокислотных остатков особенно часты.
То, что активный центр антитела формируется аминокислотными остатками гипервариабельных областей.
Антитела одной специфичности имеют идентичный или очень сходный аминокислотный состав гипервариабельных регионов.
Поскольку активный центр формируется обеими — тяжелой и легкой — цепями молекулы, бесконечное разнообразие специфичностей антител может определяться не только разнообразием вариабельных цепей, но и комбинацией сочетаний различных цепей.
Константные участки цепей ответственны за другие свойства молекулы иммуноглобулина.
В области Сн2 и СнЗ-доменов располагаются соответственно участок фиксации комплемента и участок, ответственный за фиксацию антитела к клеткам, например к макрофагам, тучным клеткам или лимфоцитам.
Четыре подкласса IgG человека лишь слегка различаются по аминокислотной последовательности тяжелых цепей.
Этими различиями обусловлены изотипические вариации расположения и числа межцепочечных дисульфидных связей.
IgM.У человека IgM обычно обнаруживается в виде пентамера основной четырехцепочечной структурной единицы.
Отличие его μ-цепи от γ-цепей IgG состоит в иной аминокислотной последовательности и наличии дополнительного константного домена с С-концевым пептидом из 18 аминокислотных остатков.
Молекулу IgM характеризуют добавочная пептидная J-цепь (от англ. joining — соединение), которая предположительно принимает участие в полимеризации мономерных единиц, предшествующей выходу IgM из синтезирующей его клетки.
J-цепь полипептид сшивающий 5 мономеров в один пентамер.
IgA. Тяжелая α-цепь свертывается с образованием четырех доменов: Vh, Cαl, Сα2 и СαЗ.
Аналогично IgM тяжелая цепь IgA содержит пептид - J-цепь соединяющей две молекулы мономера образованием димера.
Секреторный IgA (slgA) представлен главным образом димерной формой.
Полностью собранная молекула состоит из двух мономеров IgA: одного секреторного компонента -SC и одной J-цепи.
Cекреторный компонент защищает IgA от протеолиза в просвете кишечника.
IgE.Молекула IgE состоит из более крупных (по сравнению с другими изотипами) ε-цепей, содержащих большее число аминокислотных остатков и образующих пять доменов (Vh, Cεl, Сε2, СεЗ, и Сε4).
Между молекулами антител возможны изотипические, аллотипические и идиотипические различия в аминокислотной последовательности.
Дата добавления: 2017-03-12; просмотров: 5195;











