Типы растворов, термодинамика растворения
Растворы имеют важное практическое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи связаны с переводом питательных веществ в раствор. Растворами являются все физиологические жидкости, например, такие как кровь, лимфа. В основе многих производств лежат химические процессы, связанные с использование или производством растворов. Например, молочные продукты, творог, сметана, кефир, соки, напитки.
Молекулярным или истинным раствором называется гомогенная система, состоящая из двух и более компонентов. От молекулярных растворов следует отличать коллоидные растворы: суспензии, эмульсии, аэрозоли. Коллоидные от молекулярных растворов отличаются тем, что они представляют собой многокомпонентные гетерогенные системы. Примерами молекулярных растворов являются водный раствор хлористого натрия, воздух, сплав серебра с золотом. Уже из приведенных примеров видно, что типы растворов могут быть разные.
Растворы могут находиться в трех агрегатных состояниях: газообразном, жидком, твёрдом. Поэтому различают жидкие растворы, газовые растворы, твердые растворы. Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, который находится в том же агрегатном состоянии, что и сам раствор. Если все компоненты находятся в одинаковом состоянии, то растворителем считается тот компонент, который находится в большем количестве. Очень большое распространение имеют водные растворы, в которых растворителем является вода, например: водный раствор соляной кислоты, водный раствор спирта.
Жидкие растворы обладают элементами кристаллической структуры. В них имеется ближний порядок, то есть каждая частица раствора окружена определенным числом других частиц, находящихся от данной на строго определенном расстоянии. Для более удаленных частиц этот порядок нарушается. Растворы, как и все жидкости, не обладают дальним порядком, который наблюдается в кристаллах.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. Однородность раствора делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах растворах можно обнаружить многие свойства его отдельных компонентов, что не наблюдается у химических соединений. Непостоянство состава раствора приближает их к механическим смесям, но от последних они резко отличаются своей однородностью.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. В таких растворах при заданной температуре не может раствориться большее количество растворенного вещества. Насыщенный раствор находится в динамическом равновесии с нерастворимой частью растворяемого вещества. Например, если поместить в воду избыточное количество хлорида натрия, образуется насыщенный раствор, в котором твердый хлорид натрия находится в динамическом равновесии с растворенным хлоридом натрия
NaCl (тв.) 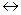 NaCl(водн.).
NaCl(водн.).
Большинство кристаллов растворяется в жидкостях с поглощением теплоты, однако при растворении таких веществ, как гидроксид натрия NaOH, карбонат калия K2CO3, сульфат меди CuSO4 происходит заметное увеличение температуры раствора. Выделяется теплота, но в меньших количествах, при растворении некоторых жидкостей и всех газов.
Количество теплоты, которое поглощается или выделяется при растворении одного моль вещества, называется теплотой растворения этого вещества. При растворении кристаллов происходит их разрушение, что требует затрат энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если наблюдается обратный эффект, то это говорит о том, что помимо растворения происходит взаимодействие между растворителем и растворенным веществом, в результате которого выделяется энергии больше, чем её расходуется на разрушение кристаллической решетки.
При растворении кристаллического вещества воде происходит сближение его частиц с дипольными молекулами воды, потенциальная энергия уменьшается, и теплота выделяется, то есть растворение сопровождается сжатием, которое рассматривается как уплотнение молекул растворителя вокруг каждой частицы растворяемого вещества. При этом частицы химически связываются с молекулами растворителя, образуя соединение, которое называется сольватом.
Совокупность молекул растворителя, окружающих частицу растворенного вещества, называется сольватной оболочкой. Взаимодействие молекул растворителя с частицами растворенного вещества называется сольватацией.
Если растворителем является вода, то сольватация называется гидратацией, а сольватную оболочку называют гидратной. Соединения молекул растворенного вещества с молекулами воды называются гидратами.
Гидраты, образующиеся в результате донорно-акцепорного взаимодействия, представляют собой частный случай комплексных соединений. Предположение о существовании в водных растворах гидратов было высказано и обосновано в 80-х годах 19 века Д.И. Менделеевым. Он считал, что растворение – это не только физический процесс, но и химический, что вещества, растворяющиеся в воде, образуют с ней соединения.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Растворимость.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества служит его содержание в насыщенном растворе при определенных условиях. Численно растворимость выражается теми же способами, что и состав. Например, процентное отношение массы растворенного вещества к массе насыщенного раствора, или количество растворенного вещества, содержащегося в 1 литре насыщенного раствора. Иногда для характеристики растворимости используют коэффициент растворимости. Коэффициентом растворимости называется число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя.
Растворимость различных веществ в оде изменяется в широких пределах. Если в
100 г воды растворяется более 10 г вещества, то такое вещество считается хорошо растворимым. Если растворяется менее 1 г вещества, то его считают малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод). Это подтверждает эмпирическое правило «подобное растворяется в подобном».
Растворимость зависит от температуры. Для некоторых веществ такая зависимость имеет слабый характер. Например, растворимость нитратов калия, свинца, серебра (KNO3, Pb(NO3)2, AgNO3) в воде резко увеличивается с повышением температуры. Растворимость хлорида натрия (NaCl) в воде лишь незначительно изменяется по мере повышения температуры.
При растворении твердых тел в воде объём системы обычно изменяется незначительно. Поэтому растворимость твердых тел в воде практически не зависит от давления.
Жидкости могут растворяться друг в друге. Некоторые из них, например, спирт – вода, неограниченно растворимы, то есть смешиваются друг с другом в любых пропорциях. Есть жидкости, которые взаимно растворимы лишь до определенного предела, их называют частично смешивающимися. Если взболтать диэтиловый эфир с водой, то образуются два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. Для таких систем с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже 66,4 0С фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Для системы вода – фенол температура 66,4 0С является критической температурой растворения, так как начиная с этой температуры и выше, обе жидкости неограниченно растворимы друг в друге.
Ограниченно растворимыми жидкостями являются следующие системы: нитробензол – н-гексан, триэтиламин – вода, никотин – вода.
Взаимное растворение жидкостей обычно не сопровождается значительными изменениями объёма, поэтому мало зависит от давления. Лишь при очень высоких давлениях порядка тысяч атмосфер взаимная растворимость жидкостей существенно возрастает.
Встречаются жидкости, которые полностью нерастворимы друг в друге, их называют несмешивающимися жидкостями. Если обе жидкости нерастворимы одна в другой, то при смешивании в любых пропорциях образуется два отдельных слоя. Примерами таких жидкостей являются следующие: ртуть – вода, дисульфид углерода – вода, хлорбензол – вода, фениламин – вода.
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещство, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет расперделяться между обеими жидкостями, пропорционально своей растворимости в каждой их них. Для таких систем выполняется закон распределения согласно которому:
вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества
К(В) = с1В/с2В,
где с1В и с2В – концентрации растворенного вещества в первом и втором растворителях, К(В) – константа распределения вещества В между двумя несмешивающимися жидкостями.
Например, константа распределения йода между хлороформом и водой равна 130. Если к воде, содержащей растворенный йод, добавить несмешивающийся с нею хлороформ, взболтать эту систему и дать её отстояться, то после установления равновесия концентрация йода в хлороформе будет в 130 раз выше, чем в воде, независимо от общего количества растворенного йода. Таким образом, с помощью хлороформа можно извлечь из воды преобладающую часть растворенного в ней йода. Такой способ извлечения растворенного вещества из раствора с помощью второго растворителя, несмешивающегося с первым, называется экстракцией.
Закон распределения имеет ряд важных применений. Наиболее известные – это жидкофазная хроматография и экстракция.
Две несмешивающиеся жидкости иногда используют как селективные растворители для компонентов какой-либо смеси. Такую смесь сначала встряхивают с двумя несмешивающимися жидкостями, а затем отделяют одну жидкость от другой. Каждый слой по несколько раз подвергают экстракции с другим растворителем.
Например, данный способ используется для выделения солей урана из продуктов ядерного деления. Уранильную соль UO2(NO3)2 отделяют от NaCl с помощью бутанола и воды по методике противоточной экстракции. Известно, что уранильная соль лучше растворима в бутаноле, а хлористый натрий в воде. Один из растворителей пропускают над твердой смесью, находящейся в колонке. Затем над смесью в противоположном направлении пропускается другой растворитель. Для получения полного разделения этот процесс повторяют несколько раз.
Дата добавления: 2017-02-13; просмотров: 3424;











