Зависимость свойств сплава от вида диаграммы состояния (закономерности Курнакова)
Впервые на зависимости между видом диаграммы и свойствами сплавов в равновесном состоянии указал российский ученый Н.С. Курнаков, и поэтому они называются правилами Курнакова. Оказывается, если известны свойства чистых компонентов и вид диаграммы состояния для этой системы сплавов, то можно предсказать свойства любого сплава данной системы.
На рис. 61 показаны рассмотренные типы диаграмм состояния сплавов и соответствующее им изменение свойств (твердости по Бринеллю HB и относительного удлинения δ) при комнатной температуре. Конечно, другие свойства подчиняются таким же закономерностям.
У неограниченных твердых растворов свойства изменяются по криволинейной зависимости (рис. 61, а). Они могут иметь, например, более высокие значения прочностных характеристик, чем у чистых компонентов. Особенно сильно проявляется в твердых растворах криволинейная зависимость изменения электросопротивления, что используется при построении диаграмм состояния.
Если сплав представляет собой механическую смесь компонентов, то свойства сплавов изменяются линейно, пропорционально концентрации (рис. 61, б). Другими словами – значение любого из свойств сплавов будет изменяться только в пределах свойств чистых компонентов.
В системе сплавов с ограниченными твердыми растворами свойства в области твердого раствора изменяются по криволинейной зависимости, а в областях, где присутствует эвтектика, – по линейной зависимости (рис. 61, в).
 |
а б в г
Рис. 61. Изменения свойств сплавов в зависимости от концентрации компонентов
Если образуется химическое соединение, то зависимость свойств от состава сплава резко изменяется при переходе через эту точку (рис. 61, г).
Лекция 9
Диаграмма состояния железоуглеродистых сплавов
Компоненты и фазы
Компонентами в сплавах железа с углеродом являются металл железо и неметалл углерод.
 |
Железо (Fe) имеет температуру плавления 1539 ºC. В твердом состоянии испытывает два полиморфных превращения. Важнейшее из них – превращение при 911 ºC. Ниже этой температуры железо имеет объемно-центрированную кубическую решетку (ОЦК) с параметром a = 0,286 нм (рис. 62, а). Это α-железо (Feα). Выше 911 ºC существует γ-железо (Feγ) с гране-центрированной кубической решеткой (ГЦК) и параметром a = 0,364 нм (рис. 62, б).
а б
Рис. 62. Кристаллическая решетка a-железа (а) и g-железа (б)
α-железо ферромагнитно, а высокотемпературная модификация Feγ парамагнитна, что позволяет легко обнаруживать тот и другой вид решетки магнитными методами.
Высокотемпературное превращение γ-железа в δ-железо с ОЦК решеткой меньше влияет на структуру и свойства сплавов, поэтому далее не рассматривается. Обозначение β-железо присвоено парамагнитному железу с ОЦК решеткой, которое существует от точки Кюри (768 ºC) до 911 ºC.
Углерод (C) при нормальных условиях существует в виде графита с гексагональной слоистой кристаллической решеткой. Углерод не плавится при нагреве, а возгоняется (переходит в газовую фазу) при температуре
3800 ºC. Он мягкий, непрочный, хорошо проводит электричество.
Модификация алмаза с решеткой, где каждый атом имеет четыре равноудаленных соседа, стабильна только при высоких давлениях и температурах. В сплавах с железом алмазная решетка углерода не встречается.
Какие же фазы образуют при взаимодействии эти столь непохожие компоненты?
Углерод может растворяться в жидком железе и в решетках обеих полиморфных модификаций, а также образует с железом химическое соединение. Поэтому в сплавах могут присутствовать следующие фазы: жидкий раствор (Ж), феррит (Ф), аустенит (А), цементит (Ц), графит (Г).
Феррит – это твердый раствор внедрения углерода в α-железо с предельной растворимостью 0,02 % С. Атомы углерода размещаются в дефектах кристаллической решетки железа, так как поры ОЦК решетки для них слишком малы (рис. 63, а). Феррит мягок и пластичен: 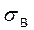 = 300 МПа, d = 40 %, HB = 80-100.
= 300 МПа, d = 40 %, HB = 80-100.
 |
Аустенит – это твердый раствор внедрения углерода в γ-железо с предельной растворимостью 2,14 % С. Атомы углерода размещаются в порах ГЦК решетки железа (рис. 63, б). Аустенит пластичен, но прочнее феррита: HB = 160-200, в зависимости от концентрации углерода.
а б
Рис. 63. Кристаллическая решетка феррита (а) и аустенита (б)
Цементит Fe3C– это химическое соединение углерода с железом, т.е. карбид железа, содержащий 6,69 % C. Имеет сложную ромбическую решетку, очень тверд и хрупок: его твердость составляет приблизительно 800HB. Цементит при длительном нагреве свыше 1000 ºC разлагается на железо и углерод. При быстром нагреве (лучом лазера) плавится при 1260 ºC.
Графит – это чистый углерод: мягкий, непрочный, химически стойкий, хорошо проводит электричество.
Кроме перечисленных фаз, в структуре сплавов железа с углеродом присутствуют две структурные составляющие: эвтектика и эвтектоид. Что такое эвтектика, Вам уже известно. В системе железо – углерод эвтектика содержит 4,3 % С и кристаллизуется при температуре 1147 ºC. Она представляет собой механическую смесь кристаллов аустенита и цементита и называется ледебурит (в честь австрийского ученого-металлурга Ледебура):
Л = А + Ц.
Эвтектоид – это механическая смесь кристаллов двух твердых фаз, которая образуется при распаде твердого раствора (а не кристаллизуется из жидкости, как эвтектика). В системе железо – углерод эвтектоидом является смесь пластинчатых кристаллов феррита и цементита, которая образуется за счет распада аустенита при температуре 727 ºC:
А → Ф + Ц.
Эту смесь, содержащую 0,8 % С, называют перлитом (от слова «перламутр», так как на протравленной поверхности сплава перлит дает радужную окраску, напоминающую внутренние створки раковины моллюска). Перлит имеет наиболее удачное сочетание механических свойств из всех равновесных структур в сплавах железа с углеродом. В нем мягкие, вязкие пластины феррита чередуются с прочными, твердыми, жесткими пластинами цементита: П = Ф + Ц. Такая структура хорошо сопротивляется самым разным механическим нагрузкам, обладает высокой прочностью и достаточной вязкостью. Твердость перлита составляет 180-220 HB, в зависимости от размера зерна.
Дата добавления: 2017-02-13; просмотров: 1977;











