СОВРЕМЕННЫЕ ТЕНДЕНЦИИ.
ЛАЗЕРНАЯ ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ.
Лазерная фотодинамическая терапия (ФДТ) является относительно новым методом лечения злокачественных новообразований, получившим мощное развитие в течение последних 20 лет. Хотя такой срок является недостаточным с точки зрения всеобъемлющей оценки возможностей методики (в том числе и отдаленных результатов лечения), ФДТ уверенно заняла свое место рядом с традиционными методами, такими, как рентгено-, гамма- и химиотерапия. Обусловлено это тем, что традиционные методы лечения (в том числе и хирургические) во многом оказываются малоэффективными даже при сочетанном и комбинированном применении. Поэтому новый метод, отличающийся минимальной инвазивностью, практической безболезненностью и потенциально высокой эффективностью, связанной с селективностью воздействия на патологию, сразу же привлек пристальное внимание. В развитие метода вкладываются значительные силы и средства. Научно-лечебные центры, специализирующиеся на методе ФДТ, существуют более чем в 40 странах. Ведущими являются США, Германия, Япония. В последние годы значительные успехи достигнуты в Китае.
В России метод ФДТ известен давно, однако он долгое время не был разрешен к клиническому применению и вплоть до 1992 г. оставался на исследовательском этапе.
Суть метода ФДТ состоит в использовании свойств патологических (главным образом, опухолевых) тканей накапливать некоторые вещества в значительно большей степени, чем нормальные, а затем световым возбуждением накопленных веществ (фотосенсибилизаторов) в состояние, при котором энергия возбуждения запускает определенные химические реакции, приводящие к гибели клеток, накопивших фотосенсибилизатор (ФС). Поскольку возбуждение осуществляется светом определенной длины волны, причем эффективность цитотоксической реакции возрастает с уменьшением ширины полосы поглощения ФС, очевидно, что данный метод не мог получить развития в «долазерную эпоху», хотя само по себе фотодинамическое действие света было обнаружено еще в начале ХХ века.
ФС должен обладать рядом специфических свойств, характеризующих его эффективность. Главные из них: селективное накопление в патологических клетках; избирательное и достаточно высокое поглощение лазерного излучения; способность с максимальной эффективностью передавать поглощенную энергию внутриклеточному кислороду и тем самым запускать фотохимические реакции, приводящие к гибели патологических клеток при минимальном воздействии на нормальные клетки. На сегодня можно считать установленным, что цитотоксическое действие возбужденного ФС обусловлено образованием активных форм кислорода и свободных радикалов, нарушающих клеточный метаболизм. В качестве ФС могут выступать эндогенные вещества, участвующие в метаболизме (например, порфирин IX). На основе наиболее изученных ФС разработан ряд лечебных препаратов. В России с 1992 г. примененяется в клинической практике препарат ФОТОГЕМ (аналог зарубежных препаратов ФОТОФРИН, ФОТОСАН), с 1994 г. разрешен к ограниченному применению синтетический препарат ФОТОСЕНС, представляющий собой металлопорфириновый комплекс с участием цинка или алюминия, в настоящее время проходит медицинские испытания новый препарат АЛАСЕНС на основе 5-аминоливалаланиновой кислоты (5-АLА).
Механизмы ФДТ на сегодня еще не изучены до уровня повседневных методических рекомендаций, поэтому каждый медицинский центр, где применяется ФДТ, является одновременно и научным центром. Идет непрерывный поиск и исследование новых ФС и постоянное совершенствование технических средств (лазерные источники, средства доставки излучения к объекту, средства дозиметрического контроля и управляющие устройства). В практическом плане предпринимается системно-комплексное оснащение медицинских учреждений (поставляется оборудование для кабинета ФДТ, в комплекте, полностью обеспечивающем проведение процедуры на современном уровне). Возможности метода не ограничиваются онкологией. Имеется ряд интересных сообщений о применениях ФДТ в микробиологии, дерматологии, кардиологии и ряде других областей. Метод ФДТ все увереннее занимает свое место в медицине.
Кинетика процессов при ФДТ и требования к ФС. При поглощении кванта света hn молекула ФС переходит из основного S0 в возбужденное S* состояние (рис.1). Оба эти состояния синглетны, поэтому переход S0®S* наиболее вероятен. Ближайшее к S* возбужденное состояние, расположенное чуть ниже, является триплетным и не может непосредственно заселяться из основного состояния (переход S0®T* примерно в 104-106 раз менее вероятен, чем S0®S*). Но ввиду малой разницы энергий S* и T* - состояний возможен переход молекулы ФС из S* в T*-состояние за счет спин-орбитального взаимодействия, смешивающего состояния с различной спиновой мультиплетностью. Можно найти ряд ФС, у которых вероятность перехода gик из S* в T*, называемого интеркомбинационной конверсией, близка к единице (gик ³ 0,8). Поскольку из-за тех же правил отбора излучательный переход T*®S0 запрещен, время жизни триплетного состояния Т* велико (tТ* ~ 10-1 ¸ 10-4 с). Происходит, тем самым, аккумуляция молекул ФС в состоянии Т*. Этого не могло бы происходить, если бы интерконверсия отсутствовала и вся поглощенная энергия высвечивалась бы обратно в виде флуоресценции S*®S0 (время жизни состояния S* относительно перехода S*®S0 + hnфл составляет tS* ~ 10-8 – 10-9 c). Некоторый, вообще очень слабый, фон флуоресценции всегда присутствует (gик< 1) и может быть зарегистрирован достаточно чувствительными приемниками излучения. Повышение интенсивности флуоресценции по сравнению с фоном, характерным для нормальных клеток, является признаком патологии и составляет основу люминесцентной диагностики, часто предшествующей ФДТ. Однако легко видеть, что требования к ФС, определяющие его эффективность для терапии и диагностики, противоположны: для терапии необходимо, чтобы gик ® 1, для диагностики – наоборот, gик ® 0. Аккумуляция ФС в Т*-состоянии делает возможной эффективную передачу энергии возбуждения от молекул ФС другим молекулам, в данном случае - молекулам кислорода. Основное состояние молекулы кислорода 3О2 является триплетным, тогда как ближайшие возбужденные состояния синглетны (1О2*). Наиболее устойчивым из них является состояние 1Dg, отстоящее от основного на ~ 0,976 эВ (l = 1,27 мкм). Ввиду различной мультиплетности состояний 1Dg и основного 3О2 возможна аккумуляция молекул кислорода в состоянии 1Dg . Характерное время жизни синглетного 1Dg – кислорода (1О2*) в жидкой среде сильно зависит от типа среды и может меняться в пределах 1¸ 10-5 с. При наличии в среде возбужденных молекул ФС в состоянии Т*, энергия которого близка к энергии состояния 1Dg, весьма вероятно перекрытие электронных оболочек молекул ФС и кислорода с резонансным заселением 1Dg- состояния кислорода. Этот процесс можно схематически изобразить в виде
T* [][] + 3O2 [¯][¯] ® S0 [¯][] + 1O2*[][¯]
Синглетный кислород весьма активно взаимодействует с внутриклеточными веществами. При этом возможен как физический механизм передачи возбуждения (по типу передачи энергии от ФС к самому кислороду без изменения химического состава), так и химический, при котором кислород вступает в реакцию с соответствующим веществом. Преобладание физического механизма означает отсутствие фотодинамического эффекта (ФДЭ). Это имеет место в отсутствие ФС, когда синглетный кислород образуется под влиянием естественных факторов (например, при повышенном солнечном облучении). Для реализации же ФДЭ необходимо включение химического механизма, при котором в реакцию с возбужденным 1О2* вступают ненасыщенные соединения, входящие в состав белков и липидов. Итак, требуемый ФДЭ, составляющий суть ФДТ, можно схематически изобразить в виде цепочки реакций:
S0 + hn 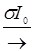 S*
S* 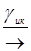 T*; T* + 3O2 ® S0 + 1O2* ; 1O2* + RH2 ®R (24.1)
T*; T* + 3O2 ® S0 + 1O2* ; 1O2* + RH2 ®R (24.1)
Здесь обозначено:
S0 – невозбужденное (синглетное) состояние ФС;
s - эффективное сечение поглощения света молекулой ФС;
I0 – интенсивность падающего излучения (Вт/см2);
S* - возбужденное синглетное состояние ФС;
Т* - возбужденное триплетное состояние ФС;
gик – квантовый выход интерконверсии;
3О2 – невозбужденное (триплетное) состояние молекулы кислорода;
1О2* - возбужденное синглетное состояние молекулы кислорода;
RH2 – химический тушитель (субстрат) – внутриклеточное либо входящее в состав мембран или межклеточной среды вещество, активно взаимодействующее с синглетным кислородом и дающее окисленный продукт R, непосредственно воздействующий на метаболизм клетки.
Защитные ресурсы клетки, препятствующие нарушению ее метаболизма, достаточно велики. Для гибели «нормально» функционирующей клетки (насколько это выражение применимо к патологическим клеткам) требуется не менее 108 молекул синглетного кислорода, а с учетом квантового выхода интерконверсии и вероятности передачи возбуждения от ФС к О2 – не менее 1010 квантов света. Таким образом, ФДЭ представляет собой «резонансное усиление» возбуждения, передаваемого от электромагнитного излучения к синглетному кислороду, за счет ФС. Коэффициент этого «резонансного усиления» составляет 108 – 109.
Схема (24.1) позволяет построить базовую систему уравнений для описания ФДЭ. Обозначим: [Р], [Рs*], [Рт] – молярные концентрации основного, синглетного и триплетного возбужденных состояний ФС соответственно; [3О2] и [1О2*] – то же для основного и синглетного возбужденного состояний молекулы кислорода ; kf и kq – константы люминесцентного распада состояний S* и T* ФС соответственно; kr - константа скорости интерконверсии; k1 – константа скорости образования 1O2*; k2 - константа окисления субстрата; k3 – константа распада состояния 1O2* всеми остальными путями, кроме окисления субстрата; k4 - константа возможного восстановления окисленного субстрата.
Тогда система кинетических уравнений для молярных концентраций соответствующих веществ запишется следующим образом:
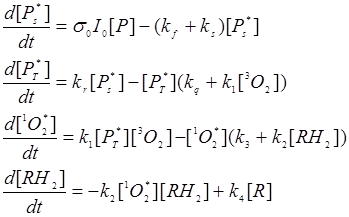 (24.2)
(24.2)
Можно показать, что скорость протекания первых трех процессов велика по сравнению с последним. Предположим также, что 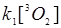 >> kq , т.е. отсутствует «кислородное голодание». Тогда для концентрации синглетного кислорода можно записать:
>> kq , т.е. отсутствует «кислородное голодание». Тогда для концентрации синглетного кислорода можно записать:
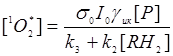 (24.3)
(24.3)
Здесь 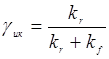 - квантовый выход интерконверсии.
- квантовый выход интерконверсии.
Подставляя (24.3) в последнее уравнение системы (24.2), а также вводя безразмерные переменные 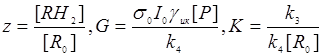 (R0 =[R] + [RH2] – суммарная концентрация субстрата ), получим:
(R0 =[R] + [RH2] – суммарная концентрация субстрата ), получим:
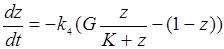 (24.4)
(24.4)
Уравнение (24.4) описывает динамику окисления субстрата. Свяжем этот процесс с процессом гибели клеток, содержащих ФС. Будем считать, что скорость повреждения клеток пропорциональна доле окисленного субстрата, а скорость репараций – доле неокисленного субстрата. При этом существует постоянная вероятность необратимой гибели поврежденных клеток. Обозначим буквами a, b, g обозначены удельные скорости переходов клеток из соответствующих состояний. Система уравнений, описывающих кинетику взаимных превращений клеток из «нормального» X состояния (насколько это приложимо к патологическим клеткам) в пораженное Y1 и в мертвое Y2, будет иметь вид:
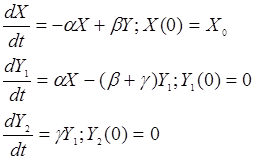 (24.5)
(24.5)
Уравнение (24.4) вместе с системой (24.5) образуют замкнутую модель поражения клеток, в которой параметры G и К являются управляющими. Константа G пропорциональна исходной концентрации препарата и интенсивности излучения. Очевидно, G ¹ 0 только на время экспозиции Т0 , т.е. G = 0 при t > T0 . Введем безразмерные переменные и параметры для системы (4)-(5), а также безразмерное время:
 (24.6)
(24.6)
Окончательно модель ФДЭ описывается системой трех дифференциальных уравнений, если учесть, что a = a0(1-z), b = b0z (z – доля неокисленного субстрата). При этом условие Y2 = 0 в (5) можно заменить условием сохранения полного числа клеток X + Y1 + Y2 = X0 :
 (24.7)
(24.7)
Решение системы (24.7) может быть получено численно при задании параметров K,G,A,B,C. Константа k4 важна для сравнения расчетных кривых с экспериментом и определяется эмпирическим путем (при наблюдении за облученными клетками через микроскоп). Справедливость описания ФДЭ системой уравнений (24.7) неоднократно подтверждалась на опыте, так что она может быть взята за основу при моделировании ФДЭ на ЭВМ . Заметим, однако, что данная математическая модель является ограниченной по своим возможностям, поскольку опирается на принципиально важное упрощающее предположение об избытке кислорода. Практические случаи характеризуются избытком кислорода далеко не всегда, в особенности при лечении поражений внутренних органов. Кроме того, она учитывает только соматические эффекты, т.е. поражение конкретных функционирующих клеток. Между тем важнейшее значение как в лечении, так и в профилактике онкологических заболеваний имеют генетические эффекты, т.е. воздействие на потомство испытавших фотодинамическое воздействие клеток. Разработка таких математических моделей представляет актуальнейшую задачу ФДТ.
Фотодинамический эффект зависит от того, где локализуется ФС (ткань органа, мембрана клетки, цитоплазма, митохондрии, ядро). Именно этот является предметом первоочередного изучения при разработке новых ФС. Очевидно, что эта проблема прямо связана с проблемой выяснения основного субстрата реакции. Она также завязана на проблему избирательного накопления ФС в патологических тканях. Даже для наиболее распространенных ФС на основе производных гематопорфирина (ПГП) нельзя признать проблему локализации решенной. Более того, обширные исследования, проведенные с этими типами ФС, привели врачей и разработчиков к убеждению, что возможности этих ФС близки к исчерпанию . Избирательность их накопления невысока (рабочая концентрация in vivo в опухолевых тканях не более чем в 2-3 раза превышает концентрацию в здоровых тканях), спектральные характеристики, определяющие выбор лазерного источника, далеки от оптимальных (5 пиков поглощения в ближнем УФ и видимом диапазоне, в том числе в наиболее удобной для ФДТ красной области пик наиболее слабый, что вынуждает работать при больших уровнях мощности и дозах облучения), токсичность препарата ограничивает возможности лечения достаточно широкого круга заболеваний. С перечисленными недостатками связаны чисто клинические побочные явления: повышение фоточувствительности кожи, воспаление и отек окружающих зону облучения тканей, накопление препаратов не только в патологических тканях, но и в кроветворных и кровоочищающих органах (печень, почки, селезенка). Тем самым возможности лечения существенно сужаются. Перечисленные трудности клинического характера, с одной стороны, заставили более объективно оценить возможности ФДТ, с другой – дали мощный толчок поиску новых, более эффективных ФС. В последние годы появилось много перспективных ФС, получивших название ФС второго поколения (если считать, что первое поколение – это препараты на основе ПГП). Для ФС второго поколения характерно наличие сильных пиков поглощения в красной и ближней ИК области, причем наиболее типичные из них имеют практически единственный пик в этой области, не «испорченный» коротковолновыми «частоколами». ФС второго поколения находятся на пороге широкого клинического применения, и в ближайшие годы следует ожидать мощного потока информации, позволяющего объективно оценить их лечебные возможности. В первую очередь это относится к препаратам типа ФОТОСЕНС фталоцианинового ряда и хлориновым, разработанным в России и СНГ (Белоруссия). Однако, несмотря на то, что ФС второго поколения еще не вошли в широкую клиническую практику, активно разрабатываются и новые ФС, именуемые (пока еще не в общепринятой терминологии) ФС третьего поколения. Для этих ФС характерно не просто продвижение в ближнюю ИК область, но и формирование интенсивных пиков поглощения в этом диапазоне, соответствующих максимальному проникновению излучения в мягкие ткани (0,8¸1,1 мкм). Это, с одной стороны, обеспечивает наиболее эффективное облучение максимально возможных объемов опухоли, с другой – позволяет достигнуть максимального контраста норма-патология с оптической точки зрения, поскольку именно в этой области спектра падают паразитные засветки за счет рассеяния (существенные в красной области), достигается максимальное отношение сигнал/шум для фотоприемных устройств дозиметрического контроля процесса облучения и имеются весьма перспективные источники лазерного и некогерентного высокомонохроматического излучения (светодиоды). Все это в принципе позволяет превратить установку для ФДТ из сложного стационарного комплекса аппаратуры в компактный и экономичный аппарат настольного типа, допускающий использование в поликлинических и амбулаторных условиях.
Опираясь на данные исследований и практического применения ФДТ, можно в общих чертах сформулировать требования к «идеальному» ФС:
1) он должен иметь доступный способ получения и обладать постоянным составом;
2) быть устойчивым при хранении и введении в организм;
3) обладать низкой токсичностью;
4) иметь высокую селективность накопления в патологических тканях и сравнительно быстро выводиться из организма;
5) слабо накапливаться в коже;
6) иметь высокий квантовый выход триплетного состояния;
7) иметь возможно более интенсивный максимум в спектре поглощения в области 700-900 нм.
Источники света для ФДТ. Идеальным является случай совпадения максимума поглощения ФС с максимумом спектральной плотности источника света. К сожалению, на практике это удается реализовать далеко не всегда (даже если in vitro желаемое совпадение достигнуто, введение препарата in situ, как правило, изменяет положение максимума ФС малопредсказуемым образом). Поэтому используется либо перестраиваемый в широком диапазоне лазер (как правило, лазер на красителе), либо широкополосный источник . Ламповые источники практически вышли из употребления, но в последнее время большой интерес вызывают источники на светодиодах, монохроматичность которых гораздо выше, чем для ламп, хотя и существенно ниже, чем для лазеров. Наиболее изученные и широко применяемые в медицинской практике препараты на основе ПГП обладают далекими от оптимальных спектральными характеристиками. В самом деле, самый интенсивный пик поглощения препарата ФОТОГЕМ расположен в районе 400 нм – там, где мягкие биоткани ввиду их существенной кровенаполненности очень плохо пропускают свет. Характерная глубина проникновения излучения здесь не превышает 1 мм, что не позволяет проводить ФДТ для имеющих практическое значение слоев биоткани (разве только для облучения новообразований в бронхах высоких порядков, что проводилось на ранних этапах применения ФДТ). Самый же длинноволновый пик поглощения, расположенный в области достаточно высокой прозрачности биотканей (625-630 нм), является настолько слабым, что требует высоких уровней интенсивности облучения (пороговое значение плотности потока составляет не менее 50 мВт/см2 , что требует обеспечения выходной мощности лазера порядка 0,5-1 Вт), а также больших концентраций препарата, что может оказаться нереализуемым ввиду его достаточно высокой токсичности. Препарат ФОТОСЕНС имеет основной (самый интенсивный) пик поглощения в районе 660-670 нм. Это позволяет снизить пороговую плотность потока излучения примерно на порядок по сравнению с препаратом ФОТОГЕМ. Тем самым открывается возможность проведения эффективной ФДТ с применением светодиодных источников, поскольку в этом диапазоне спектра сегодня имеются интенсивные светодиодные излучатели. Типичное значение выходной мощности светодиода указанного типа составляет 1 мВт в непрерывном режиме при токе через p-n-переход 10 мА и ширине спектра на уровне ½ порядка 60 нм. Достижение плотности потока порядка 10-20 мВт/см2 вполне возможно при матричном исполнении светодиодного облучателя и применении формирующей оптической системы. Ограничивающим применение светодиодных источников фактором является пока недостаточная эффективность ввода излучения в волоконные световоды, поэтому ФДТ внутренних органов остается пока прерогативой лазерных источников. Но стремительность развития светодиодных излучателей позволяет вполне уверенно утверждать, что и эта проблема в ближайшем будущем успешно разрешится.
При разработке лазерных источников для ФДТ необходимо учитывать следующие требования.
1. Близость (в идеале – совпадение) длины волны излучения к максимуму поглощения ФС в состоянии in situ. Последнее означает, что должна быть обеспечена перестройка частоты излучения в достаточно широких пределах, поскольку максимум поглощения ФС в зависимости от локализации препарата в различных тканях и клетках может меняться.
2. Возможность передачи излучения через оптическое волокно с высокой эффективностью для обеспечения проведения ФДТ как для наружных патологий, так и для внутренних органов.
3. Достаточная выходная мощность для превышения порога фотодинамического действия и необходимый запас мощности для случаев облучения больших объемов биоткани.
4. Малогабаритность, экономичность, простота управления.
Последнее требование до недавних пор не ставилось во главу угла, но с разработкой ФС второго и третьего поколений оно становится весьма актуальным. В этом плане имеются богатые возможности использования для ФДТ твердотельных лазеров с умеренными уровнями выходной мощности, работающих в импульсном режиме с воздушным охлаждением. Ряд таких лазеров допускает перестройку частоты излучения в пределах, достаточных для слежения за смещением максимума поглощения ФС in situ (например, лазеры на александрите, сапфире с титаном ). Интересны перспективы применения полупроводниковых лазеров, имеющих на сегодня уже вполне достаточную для ФДТ мощность . Несомненный интерес представляет и лазер на 2-й гармонике Nd:YAG, излучающий в красной (660 нм) области. В целом в связи с разработками ФС второго и третьего поколений имеет смысл говорить и о лазерах второго поколения для ФДТ, имея в виду, что первое поколение лазерных источников – это сложные, громоздкие и энергоемкие системы двухступенчатого типа с задающим лазером на аргоне или парах меди и последующей перестройкой частоты излучения за счет применения лазера на красителе. Сюда же следует отнести и двухступенчатые системы с задающим лазером на 2-й гармонике Nd:YAG (532 или 660 нм). Они, хотя и несколько более экономичны, чем аргоновые или медные, но не уступают им по сложности и капризности в работе. Сложность и громоздкость лазерных источников первого поколения, во многом обусловленная необходимостью применения активных сред на красителях, связана с использованием ФС на основе ПГП (ФОТОФРИН-1, ФОТОФРИН-2, ФОТОСАН, ФОТОГЕМ), обладающим слабым и сильно «ползающим» длинноволновым пиком поглощения в области 620-630 нм. Второе поколение лазеров для ФДТ – это одноступенчатые системы, разработка которых должна вестись совместно с разработкой новых ФС. В целом в ближайшем будущем следует ожидать появления семейства новых лазеров вместе с новыми ФС.
Особый интерес представляют разработки новых средств доставки лазерного излучения к объекту фотодинамического воздействия. В аппаратуре первого поколения это были, как правило, моноволоконные световоды со световедущим диаметром 200-800 мкм и длиной несколько метров. В этом случае требуется дополнительное оборудование для облучения больших объемов биоткани, с одной стороны, и для пункционного введения дистального конца световода внутрь облучаемой ткани, с другой стороны. Возникшие при клиническом применении лазерной аппаратуры первого поколения проблемы привели к появлению специальных оптических катетеров для ФДТ, которые имеет смысл рассматривать как элементы лазерной аппаратуры второго поколения. Обязательной принадлежностью такого катетера является специальный оптический наконечник на дистальном конце («optical tip»), формирующий заданное пространственное распределение интенсивности. Такие микролинзовые системы различаются на планарные (для облучения наружных образований), цилиндрические (для облучения трубчатых полостей типа пищевода или бронха) и сферические (для облучения либо внутренних полостей, либо больших объемов ткани при пункционном введении).
При разработке световодных систем принципиальное значение приобретает мониторный контроль интенсивности излучения непосредственно в сердцевине световода, поскольку обычные методы контроля вводимого в световод излучения (измерение уровня мощности на входе и выходе световода) здесь не годятся. Вообще проблема дозиметрии при ФДТ является, по сути дела, прямым следствием основной идеи ФДТ: избирательного уничтожения патологических тканей при сохранении здоровых. Если предположить, что слой облучаемой ткани достаточно тонкий, т.е. просвечивается насквозь с гарантией обеспечения поражения патологических клеток во всем облучаемом объеме , то можно дать оценку необходимой дозы облучения. Введем параметр ε0, представляющий собой произведение интенсивности поглощенного света на концентрацию ФС:
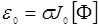 (24.8)
(24.8)
Вообще говоря, введенный параметр не является факторизованной величиной, поскольку концентрация [Ф] сама зависит от поглощенной энергии. Тем самым даже в наипростейшем случае, пытаясь оценить требуемую дозу, натыкаемся на нелинейность. Определим дозу облучения как суммарную поглощенную единицей поверхности рассматриваемой биоткани энергию за весь сеанс облучения: [J0] = Дж/см2 или Дж/м2. Тогда фотодинамическую дозу, связанную с поглощением света фотосенсибилизатором, можно найти как интеграл
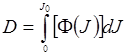 (24.9)
(24.9)
Здесь [Ф(J)] – концентрация ФС, зависящая в процессе облучения от дозы облучения («эффект обесцвечивания» ФС). Принимая для [Ф(J)] экспоненциальную зависимость,
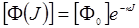 (24.10)
(24.10)
где κ – скоростьобесцвечивания, [Ф0] – начальная концентрация ФС, перепишем (24.9) в виде
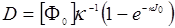 (24.11)
(24.11)
В пределе при κJ0 « 1 имеем D = [Φ0]J0 , т.е. при малых скоростях обесцвечивания фотодинамическая доза не зависит от скорости обесцвечивания, а определяется только дозой облучения. Напротив, при больших скоростях обесцвечивания (κJ0 » 1) D [Φ0] /κ , т.е. фотодинамическая доза вообще не зависит от дозы облучения. Если допустить, что скорости обесцвечивания ФС в нормальных и опухолевых тканях одинаковы, то
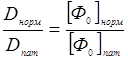 (24.12)
(24.12)
Следовательно, при достаточно быстром обесцвечивании ФС реальной является ситуация, при которой можно воздействовать только на патологические клетки, не повреждая нормальных. Однако контролируемым такое воздействие до сих пор удавалось сделать только при облучении образований, сосредоточенных в достаточно тонких слоях ткани (например, опухолях мочевого пузыря, бронхов, пищевода). Благоприятность подобных случаев лечения заключается в том, что доза D, не повреждающая здоровых тканей, но максимально поражающая патологические, может быть рассчитана заранее. Клинический опыт показывает, что в таких случаях применение ФДТ дает исключительно высокий процент успешного лечения (более 90%). Уже одно это стоит того, чтобы развивать методику, ведь именно такие случаи считаются у онкологов наиболее трудно излечимыми. Однако столь высокий процент излечения не должен вызывать эйфории, поскольку общее число больных, подлежащих такому лечению, относительно невелико. Погоду делают как раз те случаи, когда пациент угодил на ФДТ уже после того, как на нем были испробованы все возможные методы лечения, и успеха они не имели. Многочисленные попытки обеспечить оперативный и эффективный дозиметрический контроль при облучении больших объемов ткани, где при расчете фотодинамической дозы следует учитывать не только обесцвечивание ФС, но и затухание излучения при прохождении толстых оптически неоднородных слоев, до сих пор успеха не имели. Можно тем не менее указать направления исследования, двигаясь в которых, можно достигнуть необходимых результатов. Так, в ряде работ предложены методы мониторного контроля интенсивности лазерного излучения, пропускаемого через световод, основанные на применении интегральной фотометрии излучения, проходящего через оболочку световода (интегральный фотометр как бы «надевается на световод», причем для управляемого возрастания сигнала, регистрируемого фотометром, можно либо задавать изгиб световода внутри фотометрической полости, либо контролируемо повреждать оптическую оболочку). Такая методика позволяет контролировать как уровень мощности непосредственно проходящего через световод излучения, так и регистрировать «добавку», связанную с попаданием в световод диффузно отраженного излучения в процессе облучения биоткани. Если использовать сигнал с интегрального фотометра в качестве управляющего, то дозу облучения можно устанавливать в ходе оперативной обработки сигнала прямо в ходе сеанса. Безусловно, такая задача должна решаться с применением информационных технологий, поскольку при таком подходе главным элементом системы управления является ЭВМ. Современные волоконно-оптические технологии позволяют изготавливать не только моноволоконные световоды для передачи излучения во внутренние полости, но и специальные многоволоконные оптические катетеры, позволяющие передавать оптическое изображение исследуемой области. Такой катетер может быть введен в инструментальный канал эндоскопа, а может вводиться и самостоятельно, пункционным образом. В качестве примера можно привести отечественный комплекс «Фотодин», сочетающий в себе как диагностические возможности (фоконный волоконно-оптический зонд, позволяющий передавать люминесцентный «портрет» операционного пространства, регистрируемый ПЗС-камерой и запоминаемый ЭВМ), так и терапевтические (избирательное воздействие на операционную область с использованием светомодулирующего устройства, задающего пространственное распределение интенсивности облучения в соответствии с люминесцентным «портретом»). Управление светомодулирующим устройством с помощью ЭВМ позволяет в режиме реального времени отслеживать изменения в операционном пространстве и автоматически изменять параметры воздействия. Комплекс «Фотодин» представляет собой прототип аппаратуры для ФДТ третьего поколения, где возможен концептуальный прорыв в лечении онкологических заболеваний с применением информационных технологий. Он пока не имеет зарубежных аналогов, если только не считать заграницей Белоруссию, Украину и Армению.
Обрисуем кратко применения ФДТ за пределами онкологии. Эти направления разработок возникли отчасти из-за того, что надежды на «чудо», избавляющее от злокачественных опухолей через ФДТ, в значительной мере не оправдались – чудес в науке, как известно. не бывает, отчасти и из-за того, что в разработки аппаратуры и препаратов для ФДТ были вложены огромные средства, которые очень хочется вернуть с прибылью. А если в онкологии это происходит медленно и с большими трудностями, то, может быть, повезет в тех областях, где вылечить пациента не так трудно, зато престижно и можно выручить хорошие деньги. Этот откровенно коммерческий подход к ФДТ превалирует сегодня на Западе.
В борьбе между лавинообразным появлением новых ФС и строгостями FDA (аналог нашей комиссии Минздрава, без разрешения которой ни один препарат и ни один образец медицинской техники не может официально применяться в клинической практике) особенно приметны следующие фирмы: Dusa Pharmaceuticals Inc. (Торонто, Канада); Miravant Medical Technologies (Санта-Барбара, США); Pharmacyclics Inc. (Саннивэл, США); QLT Photo Therapeutics of Vancouver (Британская Колумбия, Канада); Scotia Quantanova (Гилфорд, Великобритания); Ergo Science Corp. (Чарлстоун, США).
Большинство ФС вырабатываются из природных продуктов, связанных с производными гематопорфирина. Однако на сегодня имеется ряд новейших препаратов, полностью синтезированных и обладающих уникальными свойствами. Так, 5-аминоливалаланиновая кислота (5-АLА), разработанная Dusa Pharmaceuticals под названием ЛИВАЛАН (Levulan), производит особенное лечебное воздействие: вместо того, чтобы самой работать как ФС, она заставляет организм усиленно производить собственные ФС. В метаболизме клеток организма всегда присутствует генерация протопорфирина lХ (Рр lХ), который является сырьем для производства гемопротеинов (в первую очередь, гемоглобина). Обычно генерация Рр lХ сбалансирована потребностями организма в гемопротеинах, но в присутствии 5-АLА Рр lХ генерируется в избытке и накапливается в клетках. Введение 5-АLA в опухолевые ткани сенсибилизирует их, заставляя производить избыточный Рр lХ. Облучая затем сенсибилизированные ткани, можно традиционным для ФДТ способом уничтожить их. В отличие от других ФС, 5-АLA изготавливается в любой форме: раствора, геля, крема и т.д. Фирма Dusa рекомендует применять препарат (сейчас эта методика находится на рассмотрении FDA) для лечения актиничных кератозов (actinic keratosis), часто предшествующих раку кожи.
Сегодня большие надежды связываются с двумя семействами ФС: бактериохлорины (производные из хлорофилла, вырабатываемого бактериями) и бензофеноцианины (ВРТ), являющиеся полностью синтетическими препаратами. Компания Scotia Pharmaceuticals’ разрабатывает препарат SQN400 бактериохлоринового ряда. Основным преимуществом SQN400 является наличие главного максимума поглощения на 740 нм. Фирма Ergo Science Corp., позже других приступившая к разработкам ФС, специализируется на бензофеноцианинах (ВРТ). Фирма приступила к разработкам ФС, действие которых принципиально отличается от препаратов порфиринового семейства. Исходя из того, что препарат должен быть химически нейтральным, но при этом избирательно накапливаться в опухолевых клетках, синтезировано около 25 таких соединений. Они обладают широкой полосой поглощения в красном диапазоне и более эффективны, как ФС, чем большинство порфиринов. К тому же они внедряются и выводятся из организма гораздо быстрее, так что облучение можно проводить не позже 3 часов после введения препарата, а выведение из организма происходит не дольше 24 часов. Основным преимуществом этого типа ФС, по данным предварительных исследований, является не собственно цитотоксическое действие препарата, а стимуляция иммунных реакций организма. Разработки не замыкаются на онкологических применениях ФС.
Одно из наиболее актуальных применений ФДТ за пределами онкологии – это лечение «мокрой» отслойки сетчатки, приносящей страдания в пожилом возрасте. Заболевание заключается в разбухании кровеносных сосудов в слое ткани, подстилающем фоторецепторный, особенно в области желтого пятна и центральной ямки. Разбухание сосудов может привести к кровоизлияниям, что не позволяет фоторецепторным клеткам функционир
Дата добавления: 2017-01-26; просмотров: 4253;











