офтальмологической хирургии.
Аппаратура для лазерной
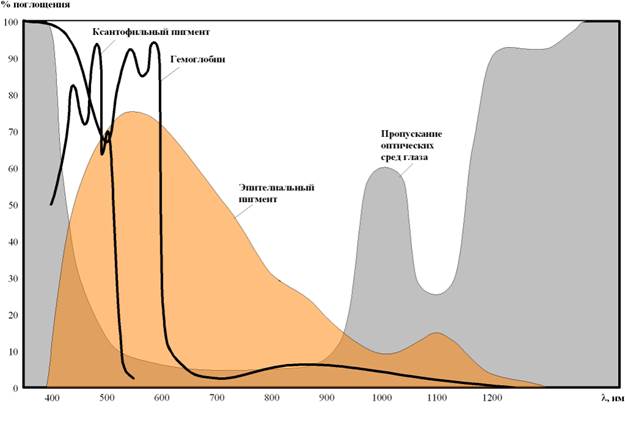 |
Применение лазеров в офтальмологии явилось первым практическим использованием лазеров в медицине (1963г). Это обусловлено значительно более высокой (по сравнению с кожей и другими мягкими тканями организма) чувствительностью органа зрения к электромагнитному излучению. Соответственно спектральная зависимость этой чувствительности носит специфический характер. Если для мягких тканей организма основное значение имеет поглощение гемоглобином и водой, то для глаза картина сложнее (рисунок 20.1).
Рисунок 20.1. Поглощающие среды глаза
Глаз заполнен эпителиальным пигментом, хотя и состоящим в основном из воды, но содержащим добавки, сильно влияющие на поглощение излучения. Существенную роль во взаимодействии с электромагнитным излучением играет и пигмент желтого пятна (ксантофильный пигмент). Поэтому в видимой и ближних ИК и УФ областях — там, где поглощение водой несущественно, — необходимо учитывать не только гемоглобин, но и оба упомянутых пигмента. Именно, ксантофильный пигмент преобладает в коротковолновой части видимого спектра (0.44 – 0.46 мкм), а эпителиальный пигмент — в красной области (0.6 – 0.8 мкм). В результате приближенные рекомендации к применению лазеров для воздействия на различные отделы глаза следующие: для передних отделов (роговица, хрусталик) лучше использовать либо длинноволновую область (> 0.6 мкм), либо короткие волны (< 0.3 мкм) благодаря их сильному поглощению в роговице и хрусталике. Для воздействия на глазное дно и сетчатку (проникновение сквозь стекловидное тело) наилучшей является сине-зеленая область 0.45 – 0.55 мкм, т.е. следует держаться в районе максимума кривой видности (спектральной чувствительности глаза). Следует учитывать также возможный сдвиг кривой видности в зависимости от интенсивности излучения. В частности, при изменении интенсивности в широком диапазоне могут смещаться не только максимум кривой видности, но и сами границы видимого диапазона, особенно красная. В свете этого замечания, несмотря на явно неудачный выбор длины волны для первого промышленного офтальмокоагулятора (0.694 мкм), практический опыт применения аппаратов данного типа в течение многих лет дал в основном положительные результаты, в том числе с учетом отдаленных последствий. Тем не менее дальнейшие разработки офтальмокоагуляторов ориентировались главным образом на аргоновые лазеры (l = 0.488 – 0.514 мкм) или 2-ю гармонику АИГ:Nd-лазера (l = 0.532 мкм). Следует отметить общую конструктивную особенность всех типов офтальмокоагуляторов: излучение лазера направляется в глаз сильно сфокусированным пучком, фокус которого сосредотачивается на глазном дне. Через передние отделы глаза излучение проходит широким пучком и при рабочих интенсивностях ничего не повреждает. При больших интенсивностях (если используется тот же рубиновый лазер) глаз ведет себя как нелинейная система: чувствительность сетчатки падает, а промежуточные ткани просветляются.
В 60-е годы минувшего века появилось много различных установок для лазерной хирургии глаза, причем обозначились две противоположные тенденции: универсализация, т.е. стремление совместить в одной установке как можно больше функциональных возможностей, и специализация, т.е. намеренное ограничение функций, зато с гарантиями их как можно лучшего исполнения. В отечественной офтальмологии длительное время преобладала первая тенденция, в зарубежной — вторая. И та, и другая имеют достаточно убедительные обоснования. Тенденция к универсализации была более прогрессивной на той стадии развития, когда каждая установка была больше научным центром, чем инструментом для практического лечения. В 60-е годы во взаимодействии лазерного излучения с тканями глаза было слишком много невыясненного, поэтому чем больше возможностей давала конкретная установка, тем больший интерес она вызывала у врачей. Начиная с середины 70-х годов, возобладала вторая тенденция, потребовавшая от разработчиков резкой смены ориентации. Специализированные установки дешевле, они проще в работе, надежнее, они позволяют пропускать в единицу времени большее количество пациентов, словом, для практической медицины они лучше.
Ситуация усугубилась с внедрением коммерческих мотивов в медицину. На мировом рынке продажа лазерного офтальмологического оборудования в 1990 г. составила около 1 млрд. долл., причем за 5 лет объем продаж увеличился на порядок. До настоящего времени аппараты коагулирующего типа выпускаются главным образом на базе ионных лазеров (аргоновых и криптоновых). Аргоновые лазеры для офтальмологии работают в диапазоне мощностей в непрерывном режиме до 5 Вт (большей мощности здесь не требуется). Наиболее высокий уровень технологии производства ионных лазеров достигнут в США. Несмотря на то, что очень много фирм во всем мире выпускают установки для офтальмологии под своей маркой, подавляющая часть их содержит излучатели американского производства. Однако, несмотря на впечатляющие достижения технологии, ионные лазеры непрерывного режима имеют ряд принципиальных недостатков. Их первопричиной является низкий КПД газовой активной среды, ведущий к большой потребляемой мощности и заставляющий использовать трехфазное питание и магистральное водяное охлаждение. На низкий КПД косвенно завязана необходимость пропускания через разрядный промежуток больших токов, а это означает относительно малый срок службы активных элементов (при нормальной эксплуатации ни одна из установок на ионных лазерах не в состоянии работать более года, поэтому требование окупаемости носит достаточно напряженный характер). На низкий же КПД завязаны относительно большие габариты и вес установок, а также сложность выполнения требований электробезопасности. Все это заставило искать принципиально иные решения задач микрохирургии глаза. К концу 70-х годов появились опытные, а затем и промышленные образцы установок, работавших не в непрерывном, а в импульсно-периодическом режиме. Прежде всего, это относится к установкам на ионных лазерах — в плане преодоления перечисленных принципиальных трудностей. Переход к импульсно-периодическому режиму, во-первых, позволил отказаться от водяного охлаждения, во-вторых, снизить потребляемую мощность настолько, что трехфазное питание не требуется; в-третьих, что наиболее существенно в офтальмологии, где прецизионность является главным залогом успеха, можно реализовать фотоабляционный режим разрушения биотканей. Благодаря подобным конструктивным особенностям, ионные лазеры до сих пор остаются широко применяемыми для прецизионных операций на глазном дне. Но в последние годы у них появился мощный конкурент — лазеры на активированном волокне. Использование волоконного инструмента для подвода излучения к глазному дну, минуя оптическую ось, открывает невиданные до сих пор возможности для коагуляции и других радикальных воздействий на глазное дно (например, фотодинамических).
Попытки использовать лазеры видимого и ближнего ИК диапазонов для операций на передних отделах глаза не увенчались успехом по понятным причинам: здесь излучение должно быть за пределами видимого диапазона. Излучение с длиной волны короче 0.35 мкм и длиннее 1.5 мкм не способно проникнуть в глаз дальше хрусталика.
Поскольку с середины 70-х годов стали активно осваиваться лазерные скальпели па базе СО2-лазеров, а также получили широкое распространение лазеры на азоте (l = 0.337 мкм), внимание прежде всего было обращено на них. Большой запас мощности СО2-лазеров позволяет проводить операции по удалению патологий значительного размера, причем работа в суперимпульсном режиме дает возможность работать при фотоабляционном разрушении тканей. Однако большая длина волны все же не позволяет добиться нужной прецизионности. В частности, микрооперации на хрусталике оказываются для CO2-лазера невозможными. Поэтому CO2-лазеры используется в офтальмологии для довольно ограниченного круга задач (как правило, это либо травматические повреждения значительных размеров, либо патологические образования на мягких тканях глаза). Лазер на азоте вообще не нашел своего места в офтальмологии по двум причинам: малые уровни энергии в импульсе (не более 1 мДж) вынуждают увеличивать время операции либо частоту повторения импульсов, что сужает возможности хирурга, а, кроме того, излучение с данной длиной волны может вызывать отдаленные последствия типа катаракты.
Неудача с N2-лазером, с одной стороны, дала сигнал к разработке мер защиты от ультрафиолетового излучения, с другой — заставила более тщательно исследовать УФ диапазон на предмет поиска более безопасных длин волн и повышения энергии в импульсе с целью радикального сокращения дозы облучения при операции. В этом плане новую страницу в офтальмологии открыли эксимерные лазеры, позволяющие получать энергию в импульсе до нескольких Дж и варьировать длину волны в зависимости от состава рабочей смеси от 193 нм (ArF*) до 351 нм (ХеF*). Наибольший интерес вызывает применение наиболее коротковолновых лазеров: 193 нм (ArF*), 222 нм (КгСl*), 248 нм (KrF*). Это связано с тем, что энергия фотонов при таких длинах волн достаточна для разрыва межмолекулярных связей в коллагене, протеогликанах и т.п. Более того, для этих веществ максимум экстинкции приходится как раз на длину ~ 190 нм. При использовании эксимерных лазеров удается оптимально сочетать фототермическое и фотохимическое действия лазерного излучения. Облучение передних отделов глаза импульсно-периодическим излучением эксимерных лазеров позволяет прецизионно «шлифовать» поверхность хрусталика, задавая распределение интенсивности в пространстве с помощью ЭВМ.
Не менее интересны процессы ниже порога фотоабляции. Обнаружено, что при облучении роговицы заведомо подпороговым, низкоинтенсивным излучением эксимерного лазера (это относится именно к самым коротковолновым лазерам) имеет место изменение рефракции роговицы в широких пределах (от 0.5 до 11 диоптрий), что указывает на перспективу кератомоделирования без хирургического воздействия. На сегодня можно уже с определенностью говорить, что для формирующих операций на передних отделах глаза установки на эксимерных лазерах весьма эффективны.
Но и лазеры среднего ИК-диапазона (l > 1,4 мкм) тоже нашли свою сферу применения в офтальмологии — это перфорирующие операции. Короткие импульсы ИК излучения в режиме модулированной добротности (t < 10 нс) способны пробивать в тканях передних отделов глаза микроотверстия, позволяющие, например, регулировать внутриглазное давление при глаукоме. Излучение в диапазоне 1,4–2,1 мкм характеризуется достаточно высоким поглощением тканями передних отделов глаза, но еще допускает передачу через кварцевые световоды с малыми потерями. Это позволяет проводить микрооперации на хрусталике с проникновением в поле операции через микроотверстие, достаточное только для введения световода (не более 0,5 мм в диаметре), проделанное к тому же не в роговице, а на периферии радужки. Такая методика достаточно хорошо освоена за последнюю четверть минувшего века, поскольку позволила в полной мере использовать преимущества твердотельных лазеров. Твердотельные лазеры отличаются технологичностью, надежностью, экономичностью, а потому крайне привлекательны для разработки настольных офтальмологических аппаратов, часто не требующих вообще никакой системы охлаждения. Однако и для них лазеры на активированном волокне составляют мощную конкуренцию и, по всей видимости, в наступившем веке они займут доминирующее положение.
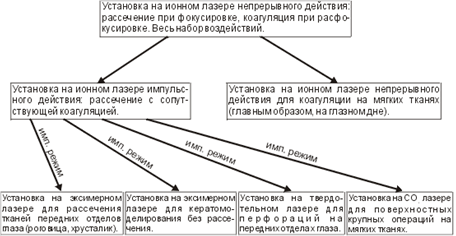
Обобщая более чем 50-летний опыт развития лазерной офтальмохирургической техники, можно констатировать, что по мере внедрения новых типов лазеров углубляется специализация аппаратов. В качестве характерного примера можно взять обсуждавшиеся установки на базе ионных лазеров. Первые установки могли работать и как скальпели, и как коагуляторы, в зависимости от фокусировки. Коагуляторы они были хорошие, скальпели плохие. Импульсные установки на ионных лазерах тоже могли выполнять обе функции — при соответствующем изменении частоты и длительности импульсов. При этом их рассекающие возможности улучшилось, а коагулирующие — ухудшились. Вместе с тем установки видимого диапазона использовались, при условии сложной и дорогой системы фокусировки, как для операций на глазном дне, так и для передних отделов глаза. Такое совмещение функций со временем перестало удовлетворять врачей, и в итоге из сравнительно универсальной установки на аргоновом лазере, которая выполняла все функции, но плохо, родилось целое семейство установок, из которых каждая выполняют только одну функцию, но хорошо. Этот процесс изображен в виде схемы (рисунок 20.2).
 |
Можно заключить, что будущее лазерной офтальмологической хирургии — за специализированными, экономичными, надежными и удобными в эксплуатации установками.
Рисунок 20.2.
Ретроспективная схема развития специализации лазерных установок
для офтальмохирургии
| <== предыдущая лекция | | | следующая лекция ==> |
| | | ЛАЗЕРНАЯ НИЗКОИНТЕНСИВНАЯ ТЕРАПИЯ |
Дата добавления: 2017-01-26; просмотров: 1253;











