воздействия лазерного излучения.
Понятие о моделях хирургического
Наиболее продвинутым на сегодня направлением в исследованиях взаимодействия лазерного излучения с биотканью можно считать хирургическое. Основа хирургического воздействия — рассечение тканей. Главный вопрос, подлежащий разрешению — формулировка условий образования кратера, т.е. выброса продуктов разрушения биоткани из зоны облучения. Поскольку главным механизмом взаимодействия в данном случае является тепловой, образование кратера возможно только при условии нарушения динамического равновесия между притоком и оттоком тепла. Приток тепла целиком относим на счет преобразования в тепло энергии лазерного излучения, а отток — на счет действия механизма теплопроводности тканей. Моделирование этого процесса затруднено изменчивостью состава биотканей в связи происходящими в них биологическими и физическими процессами. Речь идет, прежде всего, о том, что биоткани весьма неоднородны по своей структуре, состав их может сильно изменяться, и не только у разных людей, но даже и у одного человека в зависимости от изменения его состояния здоровья, стрессов, питания и т.п.
Особенно сильную роль может играть кровообращение в области воздействия и его изменение в результате самого воздействия под действием регуляторных реакций организма. Так, по мере нагрева мягких тканей лазерным излучением организм вначале пытается понизить температуру нагреваемой области за счет усиления кровотока. При этом реакция организма визуально проявляется как покраснение места нагрева. По достижении критической температуры происходит спазм сосудов вблизи нагреваемой области. Таким способом организм старается избежать перегрева прилегающих биотканей. Еще сильнее меняются характеристики биотканей, когда под действием тепла происходит изменение их физического состояния: обезвоживание, обугливание (карбонизация), увеличивающее поглощение излучения. С какого-то момента начинается выброс вещества из области воздействия.
 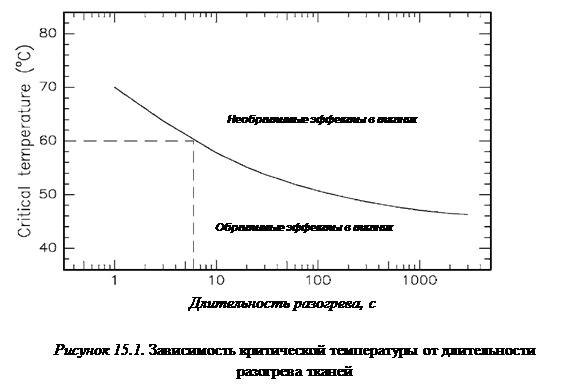 |
Прежде чем стремиться создавать приемлемые модели разрушающего воздействия лазерного излучения на биоткань, полезно иметь в виду эмпирическую зависимость «критической температуры», превышение которой означает необратимые изменения в биотканях, от длительности теплового воздействия, приведенную на рисунке 15.1 [ ].
Зависимость, представленная на рисунке 15.1, заслуживает специального внимания.
Безусловно, чересчур обобщенный характер этой кривой, не учитывающий различий в мягких биотканях, не дает возможности рекомендовать тот или иной режим разогрева в конкретных случаях, необходимый для получения требуемого лечебного эффекта. Кроме того, подобная кривая может быть построена как для нормального, так и для патологического состояния тканей. Но именно в этом и заключается ее особенное значение. В самом деле, возможно наличие точки пересечения нормальной и патологической кривых, обозначающей зону, где для одних тканей изменения будут обратимыми, а для других — нет. Следовательно, приведенная зависимость означает, что возможно селективное разрушение патологических тканей при выборе соответствующего времени разогрева до определенной температуры. В лазерной медицине такой метод лечения получил название фототермической терапии, хотя для кривой на рисунке 15.1 совершенно безразлично, каким именно образом создается соответствующий перегрев.
Для проведения количественных оценок удобно оперировать не с теплопроводностью, а с температуропроводностью тканей, поскольку через нее удобно выражается характерное время теплопотерь:
t = l2 / 4h (15.1)
где h — коэффициент температуропроводности ткани, l — характерный минимальный поперечник нагретого объёма ткани, в качестве которого естественно взять характерную глубину проникновения излучения в ткань. Это соответствует модельному представлению области взаимодействия в виде цилиндра, у которого высота меньше диаметра основания.
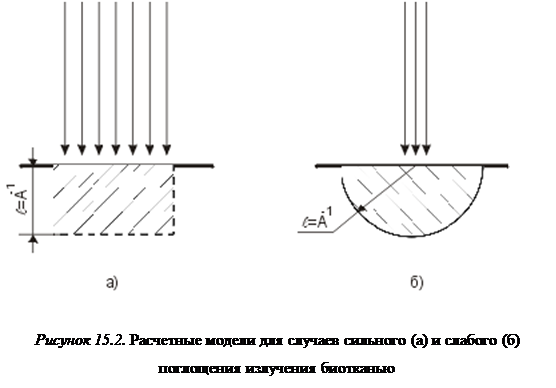
Такое представление справедливо, вообще говоря, не всегда. Оно заведомо работает в случае большого поглощения, но мягкие ткани резко увеличивают свою прозрачность в длинноволновом участке видимого диапазона и ближней ИК области (см. Л1). Если иметь в виду, что для увеличения поверхностной плотности излучения при хирургическом воздействии стремятся сосредотачивать лазерный пучок на малой площадке с поперечником lm < A-1 (А-1 — характерная глубина поглощения), то для «области прозрачности» тканей (0,6 £ l £ 1,4 мкм) справедлива не цилиндрическая, а полусферическая модель области взаимодействия. Для оценки времени теплопотерь в качестве l в формулу (15.1) следует подставлять как в том, так и в другом случаях характерную глубину поглощения (или, точнее, характерную глубину проникновения излучения в тканьA-1, где А — коэффициент экстинкции), только в цилиндрической модели A-1 — высота модельного цилиндра, а в сферической A-1 — радиус модельной полусферы (рисунок 15.2).
 |
Что же касается температуропроводности, то есть все основания считать ее не отличающейся от водяной, поскольку мягкие ткани на 80 % состоят из воды: h @1,4 * 10-3 см2 с-1. В итоге, опираясь на зависимость экстинкции мягких тканей (Л1) от длины волны, можно с помощью (15.1) составить таблицу характерных времен теплопотерь для нескольких наиболее потребительных в медицине лазеров: эксимерного на XeCl* (l= 308 нм), твердотельного на АИГ:Nd, работающего на основной (1064 нм) и 2-й гармониках (532 нм); эрбиевого (2940 нм) и газового на СО2 (10600 нм). Такой выбор лазеров обусловлен, во-первых, попаданием их длин волн в наиболее типичные с точки зрения экстинкции мягких тканей диапазоны, а во-вторых, их благоприятными для медицины принципиальными и конструктивными особенностями (таблица 1).
Для установления равновесия между притоком и оттоком тепла необходимо, чтобы время воздействия t было велико по сравнению с t. Это эквивалентно работе лазера в непрерывном режиме, хотя, как видно из таблицы 15.1, «непрерывный режим» при большой экстинкции может быть и импульсным, если только длительность импульса велика по сравнению с t. По этой причине в литературе утвердился термин «термодиффузионный режим», который нельзя признать слишком удачным (в нем смешиваются два физически различных процесса: диффузия и теплопроводность), однако, как и ряд других жаргонных выражений, он стал привычным.
Таблица 15.1 —Характерные времена теплопотерь
для наиболее употребительных в медицине лазеров
| l, нм | |||||
| А, см-1 | 7.2 | 5*103 | |||
| t, с | 4*10-3 | 0.45 | 3.6 | 7*10-6 | 7*10-4 |
Итак, если t >> t, то имеем термодиффузионный режим. Пороговая плотность мощности в термодиффузионном режиме, позволяющая разрушать облучаемую биоткань, может быть найдена из условия нарушения теплового баланса:
P ³ rVct--1 (15.2)
где r — плотность облучаемой ткани, V — объём области взаимодействия, t — время теплопотерь, c — удельная энергия разрушения, измеряемая в кДж/г.
Смысл условия (15.2) прост: за время t в облучаемый объём «вкачивается» большая энергия, чем «откачивается» за счет теплопроводности. Величину c для оценок берут из эксперимента, поскольку это проще и в большинстве случаев обеспечивает удовлетворительную точность (учитывая типичную для медико-биологических экспериментов плохую воспроизводимость результатов). Обычно c находится в интервале от 1 до 10 кДж/г (несколько бóльшие значения соответствуют АИГ:Nd-лазеру, меньшие — CO2 и XeCl-лазерам).
Рассмотрим противоположный случай: t << t. Такой режим соответствует работе лазера в режиме коротких импульсов. То, что взаимодействие лазерного излучения с биотканью в этом случае радикально отличается от термодиффузионного, было замечено еще в первых опытах с моноимпульсными лазерами (рубиновым и на стекле с неодимом).
Зона поражения в экспериментах на животных оказывалась гораздо больше зоны облучения, что заставило предположить наличие следующих процессов при импульсном воздействии:
1. внутреннее парообразование, быстрое вскипание тканевой воды;
2. локальное резкое объёмное расширение, возникновение скачка давления и, возможно, образование ударных волн.
Тем самым при импульсном воздействии энергия из зоны облучения уносится в основном не тепловым, а механическими (звуковые и ударные волны) факторами. Это значит, что область взаимодействия должна испытать достаточно сильный перегрев выше температуры кипения. Экспериментально измеренное значение Тпри импульсном воздействии составило 600 К. Опираясь на эти данные, можно оценить плотность энергии в импульсе, необходимую для подобного перегрева:
F ³ C r DT / A (15.3)
где С — теплоёмкость рассматриваемой ткани, r и А — аналогичны (15.2).
Действуя в духе сделанных приближений ( С @ 4.2 Дж г-1 К-1), можно на основе (15.3) составить таблицу пороговых значений энергии в импульсе для тех же лазеров, что и в таблице 15.1 (см. таблицу 15.2).
Полученные цифры, носящие, безусловно, оценочный характер, заслуживают, тем не менее, обсуждения. Прежде всего следует подчеркнуть принципиальное отличие режима разрушения биоткани при t<<t от термодиффузионного (t>>t). В этом случае вся тепловая энергия, получившаяся в результате преобразования энергии лазерного излучения, выделяется в зоне облучения, не успев распространиться в окружающие ткани. Такой режим получил название фотоабляционного.
Таблица 15.2 — Пороговые значения энергии в импульсе при условии t<<t
| l, нм | |||||
| А, см-1 | 7.2 | 5*103 | |||
| Ф, Дж/см2 | 2.5 | 0.1 |
Термин абляция можно часто встретить в литературе по лазерной хирургии, причем употребляемый без пояснений. В теплотехнике он означает видимое удаление вещества из зоны нагрева. Но в лазерной хирургии его следует признать крайне неудачным. Дело в том, что для последствий тепловой деструкции биоткани весьма важен размер зоны некроза вокруг области, из которой ткань удалена. В случае, если разогрев тканей происходит достаточно медленно, так, что теплопередача в окружающие ткани позволяет выполнить условие теплового баланса, или применить изотермическую модель разогрева, то зона некроза оказывается достаточно велика и обязательно содержит характерную область обугливания («черная граница»). Если же разогрев происходит достаточно быстро, так что можно воспользоваться адиабатической моделью разогрева, то ввиду малости теплообмена с окружающими тканями область обугливания либо отсутствует, либо оказывается настолько малой, что не оказывает заметного влияния на послеоперационное заживление разреза или перфорации.
Очевидно, что, в свете изложенных особенностей воздействия разогрева биоткани, совершенно неуместно пользоваться одним и тем же термином «абляция» для обоих описанных случаев деструкции биоткани лазерным излучением. Представляется поэтому целесообразным сохранить слово «абляция» только для случая отсутствия теплопередачи в окружающие ткани, применяя для случая наличия такой теплопередачи термин «термодиффузионная деструкция». При этом, чтобы отличить такую абляцию от общепринятой (теплотехнической), не следует использовать это слово без приставки, а именно: имея в виду деструкцию биоткани без теплопередачи за пределы зоны облучении, употреблять термин «фотоабляция». Такая терминология пришла из лазерной сосудистой хирургии, где размер зоны некроза имеет решающее значение для последствий операции, зачастую определяя характер прогноза для жизни пациента.
Данное определение имеет в виду только фототермический механизм разрушения биотканей. Возможным фотохимическим действием (распад гигантских молекул на фрагменты под действием лазерного излучения, без передачи энергии биоструктуре в целом) пренебрегается. Это допустимо для лазеров, входящих в таблицы 15.1 и 15.2 по причинам, изложенным выше. Справедливость этого допущения проверялась как экспериментально, так и теоретически [ ].
Отметим еще одно обстоятельство, возникающее при использовании импульсного режима облучения. Оно не имеет места в термодиффузионном режиме в виду отсутствия «взрывчатого» характера выброса продуктов разрушения. Имеется в виду возможность образования крупных частиц, представляющих особую опасность при внутрисосудистых вмешательствах. Очевидно, что эта опасность тем выше, чем больше характерная глубина проникновения излучения в ткань. Отсюда следует, что в импульсном режиме наименее предпочтителен с этой точки зрения диапазон наибольшей прозрачности биотканей (от 600 до 1400 нм).
Цифры, приведенные в таблице 2, необходимо охарактеризовать с точки зрения оценки границ применимости фотоабляционной модели. Для оценки степени повреждения окружающих зону облучения тканей введем коэффициент Кr, равный отношению тепловой энергии, диффундирующей через боковую поверхность облучаемого объёма (см. рисунок 15.2) к энергии, вложенной в этот объём:
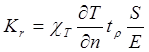 (15.4)
(15.4)
Здесь cT — коэффициент теплопроводности ткани, имеющий размерность Вт (см К)-1 (обычно в литературе по теплотехнике он обозначается l, но мы постараемся сохранить l для обозначения длины волны излучения), 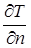 — градиент температуры по нормали к поверхности, ограничивающей зону облучения, tr — время жизни нагретого объёма, S — площадь поверхности, ограничивающей зону облучения, Е — энергия, поглощенная разрушаемым объёмом (очевидно, что для более точной оценки следует брать интеграл
— градиент температуры по нормали к поверхности, ограничивающей зону облучения, tr — время жизни нагретого объёма, S — площадь поверхности, ограничивающей зону облучения, Е — энергия, поглощенная разрушаемым объёмом (очевидно, что для более точной оценки следует брать интеграл 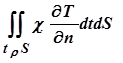 ).
).
Выражение (15.4) вообще требует исследования как с точки зрения времени жизни нагретого объёма, как и с точки зрения его формы, в соответствии с рисунком 15.2. Из концептуальных соображений ограничимся случаем цилиндрической. Время жизни tr , очевидно, определяется толщиной слоя ткани, в котором успела распространиться теплота, пока основная ее часть «занималась» внутренним парообразованием. Преобладание фотоабляционного режима означает что толщина dr, меньше предела разрешения метода регистрации термических повреждений (как правило, гистологического). Тем самым, tr можно оценить по формуле (15.4), если в качестве l подставить допустимую величину dr. Задаваясь dr @ 10 мкм (реальный порядок величины при гистологических исследованиях), получим для воды tr @ 2*10-4 с.
Легко видеть, что для различных случаев, отраженных в таблице 2, реализация фотоабляционного режима различна. Пороговая плотность энергии существенно зависит от длины волны излучения, тогда как время жизни перегретого объёма от нее не зависит. Поэтому возможна ситуация tr << t << t, при которой термические повреждения тканей обнаруживаются и в фотоабляционном режиме. Строго говоря, «истинно фотоабляционным» режим разрушения тканей следует считать только в случае t << tr, а не просто t << t, т.е. длительность импульса должна, вообще говоря, определяться не из термодинамических, а из медико-биологических соображений.
Еще одним принципиально важным обстоятельством, касающимся практической реализации фотоабляционного режима, является частота повторения импульсов f . Очевидно, что если она будет велика по сравнению с обратным временем теплопотерь, то даже при малой длительности импульса t << t возможно «наложение» теплового действия импульса на предыдущий и тем самым «включение» механизма теплопроводности, не работающего для отдельного импульса. Поэтому, наряду с учетом времени жизни перегретого объёма, необходимо соблюдать условие на частоту повторения импульсов
f £ t-1 (15.5),
ограничивающее вместе с условием (15.4) разработчика лазерных хирургических установок достаточно жесткими рамками.
Отметим еще одно обстоятельство, касающееся импульсного режима облучения мягких тканей. Экспериментально установлено, что существует зона абляции, т.е. при прочих равных условиях имеют место нижняя и верхняя границы для плотностей энергии импульса, при которых идет процесс разрушения тканей. В свете проведенных рассуждений существование нижней границы очевидно, существование же верхней границы представляет особый интерес и, по-видимому, связано с плазменным экранированием зоны облучения.
Проведем еще одно качественное сопоставление термодиффузионного и фотоабляционного режимов разрушения мягких тканей. Характерной величиной для хирургического воздействия является удельная энергия разрушения, требуемая для удаления из зоны облучения единицы массы биоткани. Для непрерывного режима c можно определить из условий изотермического процесса, для импульсного t << t — из адиабатического, причем справедливость адиабатической модели выполняется с точностью, по порядку величины совпадающей с коэффициентом Кr повреждения окружающих тканей. Тем самым корректная оценка величины c должна опираться как на термодинамические, так и на биомедицинские соображения. Учитывая достаточно большое число априори неконтролируемых параметров, такая оценка нетривиальна. Экспериментально установлено, что в фотоабляционном режиме c примерно вдвое ниже, чем в термодиффузионном, хотя разброс литературных данных настолько велик, что за критерий справедливости той или иной расчетной модели эту цифру брать нельзя.
Целесообразно представить последовательные стадии теплового разрушения мягкой биоткани в виде таблицы (таблица 15.3), хотя условность такой таблицы не уступает условности рисунка 15.1, имея в виду разнообразие характеристик биотканей и обилие априори неконтролируемых параметров процесса. Все же подобная таблица оправдана как качественная иллюстрация справедливости модельных представлений, описывающих прежде всего термодиффузионную деструкцию.
Заметим, что кажется парадоксальным наличие обратимости изменений соединительных и хрящевых тканей, имеющее место при температурах выше коагуляционной. Этот «парадокс», лежащий в основе лазерной термопластики хрящей, более подробно описан ниже, и связан как раз с тем, что различные типы тканей существенно по-разному отзываются на перегрев относительно нормальной (гомеостатической) температуры.
Таблица 15.3 — Последствия нагрева биоткани
| Температура воздействия, ºС | Реакция биоткани и результат воздействия |
| 37-42,5 | Гиперемия ткани, необратимые изменения отсутствуют |
| 42,5 - 45 | Гибель патологических клеток, в здоровых тканях можно обеспечить отсутствие необратимых изменений (денатурации белка, которая начинается при температуре 42,5 град) |
| 45-60 | Повреждение межклеточных мембран, истечение биожидкостей в межклеточное пространство (отек) |
| >60 | Коагуляция тканей (фазовый переход в гелеобразное состояние) |
| Около 70 | Обратимые изменения соединительных и хрящевых тканей |
| >100 | Выпаривание выделившихся при повреждении мембран внутритканевых жидкостей (главным образом, воды) |
| >150 | Обугливание (пиролиз и выгорание водорода из углеводородов биоткани) |
| >300 | Сублимация (возгонка) сухих обугленных остатков |
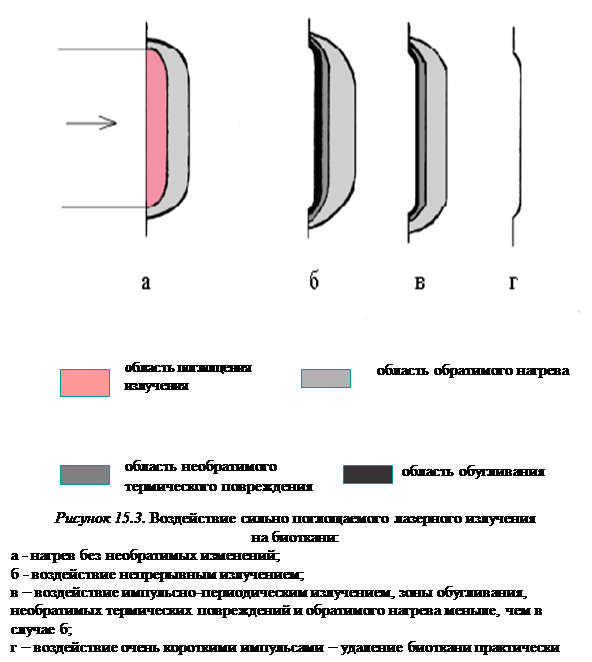
В заключение опишем качественно картину тепловой деструкции биоткани, соответствующую таблице 15.3 и часто приводимую в виде картинок без каких-либо пояснений (см. рисунок 15.3).
Пока нагрев не вызывает необратимых изменений, в биоткани можно выделить область, в которой выделяется энергия, и обратимо нагретую область (рисунок 15.3, а). По мере увеличения мощности падающего излучения ближе к поверхности появляется область, нагретая до температуры, вызывающей необратимые изменения, вначале в виде денатурации биоткани, затем коагуляции, обезвоживания и обугливания. При этом в обугленной области резко возрастает поглощение излучения, и области нагрева за обугленным слоем начинают увеличиваться медленнее. Далее с поверхности начинается выброс вещества за счет кипения, пиролиза и сублимации (рисунок 15.3, б). В этом и состоит процесс термодиффузионной деструкции.
|
Если увеличивать мощность излучения и сокращать время воздействия, проникновением тепла в течение времени импульса за пределы зоны поглощения лазерного излучения можно пренебречь. В зоне же поглощения биоткань испытывает сильный перегрев, вплоть до температур возгонки, при этом зона термического поражения остающейся биоткани будет минимальной и практически не останется карбонизации (рисунок 15.3, г). Выброшенное вещество может ионизироваться с образованием плазмы, экранирующей находящуюся за ним биоткань.
Иная картина наблюдается при воздействии на биоткани глубоко проникающим лазерным излучением (см. рисунок 15.4).
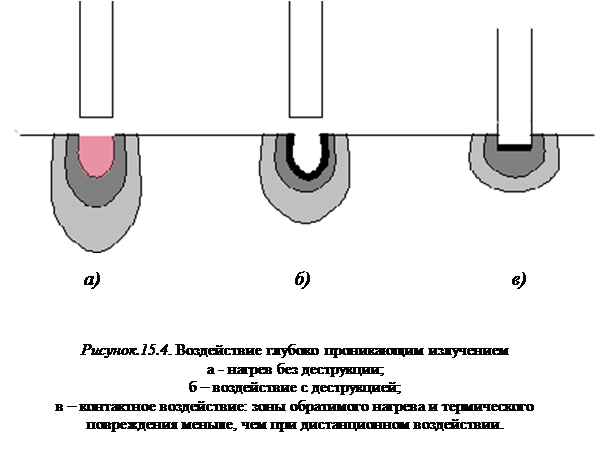
До начала удаления вещества происходит объемный нагрев биоткани (рисунок 15.4, а). Пороговый уровень мощности, при котором начинается обугливание биоткани, оказывается существенно больше, чем в предыдущем случае, поскольку поглощаемая энергия будет распределяться по бóльшему объему. Кроме того, появляется опасность теплового поражения находящихся в глубине органов. Положение можно немного изменить, если поверхность биоткани подкрасить каким-нибудь поглощающим лазерное излучение веществом, например, раствором бриллиантового зеленого или крепким раствором перманганата калия. Это приведет к локальному нагреву и обугливанию биоткани. Появившийся карбонизированный слой начинает сильно поглощать излучение, за счет этого сильно уменьшается поток энергии в глубокие слои и их нагрев (рисунок 15.4, б). Однако применение красителей вызывает побочные действия на организм, которые необходимо специально исследовать.
Еще один способ изменения характера воздействия — работа при контакте дистального конца световода с поверхностью биоткани. В этом случае появление обугливания на дистальном конце световода ведет к его разогреву, и воздействие осуществляется сочетанным действием лазерного излучения и раскаленного конца световода (рисунок 15.4, в). Глубина нагрева уменьшается. Дополнительными преимуществами такого воздействия являются малая величина отраженного от ткани лазерного излучения, лучшее использование энергии и большая точность воздействия. Однако и здесь появляются дополнительные факторы, которые необходимо специально учитывать: влияние материала световода на характер деструкции, механическое усилие, оказываемое торцом световода на биоткань, опасность излома рабочего конца световода и т.п.
Более детальный анализ режимов разрушения биотканей требует конкретизации медицинской задачи. Соответственно медицинские установки хирургического назначения подразделяются на аппараты наружных хирургических применений (лазерные скальпели и лазерные перфораторы) и микрохирургические аппараты, подразделяющиеся в свою очередь на офтальмологические установки и интракорпоральные установки, с необходимостью использующие передачу излучения по световодам для проникновения во внутренние полости организма. Микрохирургические установки офтальмологического назначения представляют собой, в сущности, самостоятельное направление разработок лазерной медицинской техники. Они исторически являются самым первым примером использования лазеров в медицине (первый аппарат такого типа ОК-1 был создан отечественными разработчиками еще в 1963 г. на базе рубинового лазера). Микрохирургические установки интракорпорального действия включают эндоскопические, ангиопластические и литотрипсионные установки. Ниже все эти типы хирургических лазерных установок будут рассмотрены подробнее.
| <== предыдущая лекция | | | следующая лекция ==> |
| Эффекты самовоздействия, параметрические эффекты и вынужденное рассеяние. | | | ЛАЗЕРЫ В ХИРУРГИИ И СИЛОВОЙ ТЕРАПИИ |
Дата добавления: 2017-01-26; просмотров: 2115;











