с биотканями. КЛАССИФИКАЦИЯ МЕДИЦИНСКИХ ПРИМЕНЕНИЙ ЛАЗЕРОВ
Взаимодействие лазерного излучения
С появлением лазеров люди столкнулись с воздействием, не имевшим ранее прецедентов в природе. Самый мощный природный источник электромагнитного излучения — Солнце, и формирование всего живого на Земле происходило под его непосредственным воздействием. Поэтому характеристики солнечного излучения с учетом его фильтрации в атмосфере считаются базовыми с точки зрения взаимодействия с биотканью. Соответственно выделение оптического диапазона длин волн электромагнитного излучения связанно именно с воздействием его на биоткань, точнее на орган зрения.
Благоприятное воздействие солнечного излучения на здоровье человека, профилактику заболеваний, процесс выздоровления при различных заболеваниях и ранениях были известны еще на заре человечества. Недаром Солнце почиталось одним из божеств большинством народов. С приходом монотеистических религий Солнце было развенчано и лечебное действие света попало в разряд ереси. Однако по мере развитие понимания природы физики света возродило интерес к его медицинским применениям и на рубеже ХIХ и ХХ столетий начался научный период светомедицины.
 |
В 1896г. датский ученый Нильс Рюберг Финзен (Niels Ryberg Finsen) создал в Копенгагене Институт световой терапии. В 1903 г за работы по изучению действия ультрафиолетового излучения на организм человека Финзен был удостоен Нобелевской премии по медицине. Он показал, что ультрафиолетовое излучение обладает лечебным эффектом, в частности при туберкулезе кожи и нагноении при оспе, а также предложил оригинальную конструкцию лампы, позволявшую использовать в медицинских целях электрическую дугу (лампа Финзена). В дальнейшем ультрафиолетовое излучение получило широкое распространение в медицине и для целей стерилизации.
В настоящее время к оптическому диапазону принято относить электромагнитные волны с частотами от 1012 до 1016 Гц, или, или, в длинах волн, от 100 до 50000 нм (в длинноволновой области, по различным классификациям, возможны вариации граничных значений). В свою очередь, оптический диапазон подразделяется на видимый спектр (400 … 760 нм), ультрафиолетовый (менее 400 нм) и инфракрасный (более 760 нм). Сами УФ и ИК диапазоны, в свою очередь, дробятся на вакуумный УФ (100 … 280 нм), жесткий УФ (280 … 315 нм) и мягкий УФ; ближний ИК (760 … 1400 нм), средний ИК (1400 … 3000 нм) и дальний ИК (>3000 нм). Указанные границы диапазонов соответствуют международной классификации, принятой SPIE (International Society for Optical Engineering) и определяются в основном поглощением электромагнитного излучения тканями живых организмов.
Биоткани, за малым исключением, к которым относятся прозрачные ткани глаза, являются для света сильно рассеивающей средой с сильным поглощением. Такие среды, как известно [1,2], называют мутными.
При прохождении лазерного излучения сквозь слой биоткани толщиной l его интенсивность ослабляется в соответствии с законом Бугера-Ламберта
I=I0exp(-μ∙l),(1.1)
где μ = μa + μs , μa и μs — соответственно коэффициенты поглощения (абсорбции) и рассеяния.
Компоненты биоткани, поглощающие лазерное излучение называются эндохромофорами. Количество типов эндохромофоров достаточно велико, но наиболее важную роль играют вода, компоненты крови, меланин, билирубин и реже протеин, который более существенен при лазерном воздействии на ткани глаза. Хромофоры определяют глубину проникновения света в био
 |
ткани и, что особенно важно, объем, в котором выделяется энергия.
Рассеяние лазерного излучения происходит на клетках биоткани и их структурных (морфологические) особенностях, которые с точки зрения оптики являются неоднородностями показателей преломления и поглощения. Рассеяние также вносит вклад в глубину проникновения излучения.
Характер проникновения лазерного излучения в биоткани существенно зависит от длины волны, на которой лазер работает.
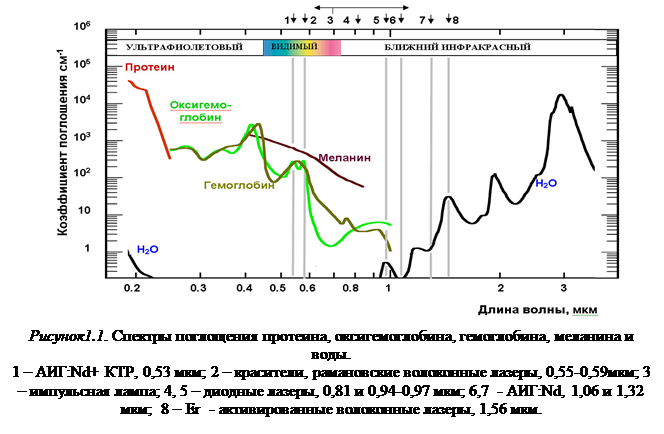
На рисунке 1.1 приведены качественные зависимости поглощения от длины волны излучения для воды, гемоглобина и меланина в оптическом диапазоне. Величина поглощения для каждого из хромофоров приведена в относительных единицах. Рисунок позволяет оценить качественную зависимость от длины волны излучения, но не позволяет проводить количественных оценок.
На рисунке 1.2 приведены кривые зависимости коэффициента поглощения в воде и цельной крови от длины волны излучения в длинноволновой части видимого диапазона и ближней инфракрасной области. Зависимости построены на основе экспериментальных работ L. Kou & D. Labrue [3] и А.Н. Ярославского с сотр. [4]. Измерения проводились для крови с показателями оксигенации >98% и гематокрита 45-46%. Именно эти два хромофора представляют наибольший интерес, поскольку играют основную роль в большинстве медицинских применений.
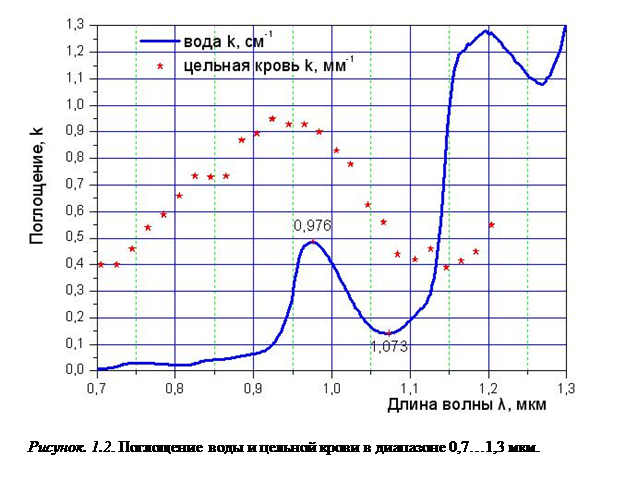
Следует подчеркнуть, что в крови, помимо поглощения, сильное влияние оказывает величина коэффициента рассеяния, которая для указанного диапазона превышает коэффициент поглощения и составляет около 65 мм-1. Благодаря рассеянию излучение в биоткани распространяется не только в первоначальном направлении, но и в стороны.
На рисунке 1.2. отчетливо виден локальный максимум поглощения в воде и крови в районе 0,97 мкм. Глубина поглощения в биотканях в этой области составляет величину порядка 1 мм, благодаря чему такое излучение обеспечивает хорошее сочетание режущих и коагулирующих свойств.
Это имеет принципиальное значение с точки зрения выбора длины волны излучения для хирургических и терапевтических воздействий.
Особенности лазерного излучения заставляют пересмотреть классические представления о взаимодействии электромагнитного излучения с биотканями. Как уже упоминалось выше, впервые появилась возможность концентрации энергии в чрезвычайно узком спектральном (как пространственном, так и временном) диапазоне. Кроме того, никакой ранее известный источник не давал столь высококогерентного излучения, как во времени, так и в пространстве. Наконец, особенности работы лазера позволяют создавать импульсы излучения с весьма малыми длительностями (до 10-14 с), что наряду с высокой когерентностью позволяет оказывать селективное воздействие на биопроцессы не только на уровне отдельных клеток, но на уровне их ядер, т.е. управлять на микроуровне процессами жизнедеятельности вплоть до воздействия на наследственность.
Когерентность лазерного излучение ведет к существенной особенности распространения лазерного излучения в рассеивающих средах, какими являются большинство биотканей. Именно, при распространении когерентного излучения в сильно рассеивающей среде из-за интерференции хаотически распространяющегося света образуются спекл-структуры («speckle» означает пятнышко, метку), то есть в формируется квазипериодическая картина ярких пятен, разделенных минимумами интенсивности. Подобную структуру легко наблюдать, если просветить мочку уха или кожную складку между пальцами светом лазерной указки. Спекл-структура не может быть получена с помощью обычных источников света и служит характерным признаком высокой степени когерентности падающего излучения.
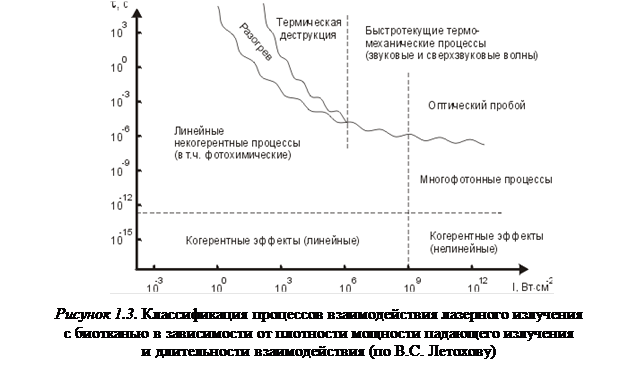
Принято классифицировать воздействие лазерного излучения на биоткань по трем параметрам: длине волны, плотности энергии (мощности) и длительности воздействия. Это позволяет изображать его графически, например, в виде диаграммы (рисунок 1.3).
В качестве обобщенной меры воздействия вводится доза облучения, определяемая как суммарная поглощенная биотканью энергия излучения.
Не умаляя достоинств предлагаемой классификации, отметим, что для наших целей (применительно к разработкам и использованию лазерных медицинских приборов и аппаратуры) она является слишком общей и трудно приложимой к конкретным медицинским предназначениям. Поэтому проведем несколько более детализированную классификацию, в известной мере за счет сужения круга рассматриваемых явлений.
Само употребление слова «воздействие» предполагает разделение лечебных и диагностических функций. Хотя в конкретных применениях медицинской аппаратуры сплошь и рядом стремятся эти функции совмещать, необходимо помнить, что с аппаратной точки зрения задачи диагностики и лечения существенно различны. Задача диагностики — возможно более достоверное извлечение информации о состоянии организма и патологических изменениях в нем. С этой точки зрения любое «воздействие» извне нежелательно, поскольку оно так или иначе искажает истинную картину происходящих в организме процессов. Однако без воздействия нет и отклика организма, который является единственным источником необходимой информации. Для диагностических применений низкоинтенсивные воздействия, не вызывающие необратимых изменений в организме, имеют куда более широкую область применения, чем высокоэффективные, после которых биоткань либо перестает существовать вообще как организованная структура, либо погибает как биоткань. Однако вообще исключать возможность диагностического применения высокоинтенсивного лазерного излучения нецелесообразно, поскольку имеется ряд примеров весьма эффективной диагностики заболеваний по анализу продуктов разрушения биоткани высокоинтенсивным излучением, по самому характеру изменения биоткани в процессе облучения и т.п. Существуют также методы лазерной диагностики, при которых воздействие осуществляется не на сам организм. Примером такого метода является одородиагностика, основанная на спектральном анализе выдыхаемого воздуха.
Поэтому диагностическое применение лазеров всегда должно быть привязано к конкретной диагностической задаче и, в сущности, не поддается общей классификации. В любом случае при диагностическом воздействии следует соблюдать условие малости энергии взаимодействия по сравнению с запасенной в объекте энергией и возможно более высокой локальности. Трудность соблюдения этих условий на практике, по-видимому, является основной причиной того, что диагностические применения лазеров до сих пор составляют ничтожно малую долю от всех применений лазеров в медицине, хотя богатейшие возможности лазерной диагностики с самого начала не вызывали и сейчас не вызывают сомнений.
Лечебное воздействие лазерного излучения принято подразделять на терапевтическое и хирургическое. Сообразно этим названиям терапевтическим считается действие лазерного излучения, не производящее видимых необратимых изменений в тканях, а хирургическим — заведомо производящее таковые. В качестве основной характеристики воздействия в таком понимании рассматривается поверхностная плотность мощности падающего излучения, измеряемая в Вт/см2 (см. рисунок 1.2). Резкой границы между терапевтическим и хирургическим воздействиями обычно не проводят, обозначая ее в районе 0,1 … 10 Вт/см2. Нижняя граница терапевтического воздействия устанавливается в районе 10-3 Вт/см2, верхняя граница хирургического — в пределах 107 – 108 Вт/см2. Ограничения при больших интенсивностях связаны с тем, что основным механизмом хирургического воздействия является тепловой, а при плотностях выше 108 Вт/см2 уже сильно проявляется фотоионизационное действие излучения, уменьшающее долю переходящей в тепло энергии и приводящей, кроме всего прочего, к плазменному экранированию зоны облучения. Ограничения при малых интенсивностях в основном обусловлены возможностями отслеживания хода процессов в организме, а также сравнением с интенсивностью солнечного облучения, которое является природным «эталоном» для калибровки шкалы интенсивностей. Размытость границы между терапевтическим и хирургическим воздействиями связана с многими причинами, и в первую очередь — с многозначностью характеристик биоткани. Различные ткани и даже одинаковые в различном состоянии при одной и той же плотности мощности облучения по-разному реагируют на воздействие. В одних случаях они могут скомпенсировать его, и тогда воздействие следует рассматривать как терапевтическое, в других — испытать необратимые изменения, и, следовательно, воздействие должно рассматриваться как хирургическое. Поэтому пограничная зона интенсивностей между терапией и хирургией и расползается на два порядка. Установление границ лечебного воздействия, безусловно, зависит от длины волны излучения. Очевидно, что если предметом облучения является объект, достаточно глубоко расположенный внутри организма, то степень воздействия на него может радикально меняться с изменением длины волны. Это еще более подчеркивает условность границ лечебного воздействия.
Количественные изменения, связанные в основном с зависимостью коэффициента поглощения тканей от длины волны, не исчерпывают всех возможностей. Преобладание фототермического эффекта, вызывающего наиболее заметные изменения в видимой и ИК областях, в УФ области переходит в фотохимическое воздействие (разрывы химических связей в молекулах органического вещества и превращение их в другие молекулы вплоть до распада на фрагменты). Граница между преобладанием фототермического и фотохимического действий и есть граница между «мягким» (UV-A) и «жестким» (UV-B) УФ-диапазонами. Поскольку диапазоны UV-B и UV-C пока что нельзя считать достаточно освоенными с точки зрения рекомендаций к массовому применению, не будем их подробно рассматривать с точки зрения перестройки по длине волны, хотя с расширением сферы применения эксимерных лазеров они становятся все более изученными.
В области «мягкого» ультрафиолета (UV-A) взаимодействие лазерного излучения с биотканями характеризуется высоким поглощением гемоглобином крови. Поэтому глубина проникновения излучения в кровенаполненные ткани весьма мала, что в случае хирургических применений дает возможность производить прецизионные разрезы с минимальным повреждением окружающих тканей (подробнее см. ниже). Область UV-A характеризуется еще и тем, что излучение этого диапазона, в отличие от UV-B и тем более UV-C относительно слабо поглощается прозрачными средами и может передаваться через кварцевые световоды с приемлемыми потерями. Поэтому лазеры, излучающие в «мягком» ультрафиолете, имеют богатые перспективы в плане медицинских применений, хотя их выбор, к сожалению, на сегодня не отличается широтой.
Лазеры видимого (VIS) диапазона обладают серьезным преимуществом над прочими с той точки зрения, что допускают непосредственный визуальный контроль. Вместе с тем, поскольку в пределах VIS-диапазона прозрачность кровенаполненных тканей сильно меняется, возможно как хирургическое для сине-зеленой, так и терапевтическое для красной областей применение.
Ближний ИК (IR-A) диапазон характеризуется наибольшей «прозрачностью» тканей (в районе 0,8 … 0,9 мкм). Глубина проникновения излучения в мягкие ткани здесь измеряется сантиметрами, а световоды, как кварцевые, так и стеклянные, обладают в этом диапазоне минимальными потерями, так что во внутренние полости организма можно передавать значительные мощности (до 250 Вт). Если необходимо использовать лазеры для терапии или остановки кровотечений, то этот диапазон, безусловно, наиболее благоприятен. Вместе с тем он наименее удобен для хирургии (рассечения и перфорирования тканей), поскольку воздействию подвергается слишком большой объём ткани и, соответственно, для его разогрева и деструкции требуется гораздо бóльшая энергия, чем в остальных спектральных областях. Однако и в ближнем ИК-диапазоне, учитывая наличие локального пика поглощения водой в области 0,976 мкм (см. выше), возможно успешное применение лазеров для хирургии и силовой терапии.
В среднем ИК (IR-B) диапазоне резко возрастает поглощение водой и падает прозрачность световодов. В этом смысле обнаруживается определенное сходство с UV-A диапазоном, с той разницей, что за поглощение биотканями в ответе не гемоглобин, а вода. Диапазон весьма перспективен с точки зрения прецизионных хирургических применений и перфорации тканей при воздействии коротких импульсов. Основная проблема на сегодня здесь связана с передачей излучения через световоды с малыми потерями.
IR-C диапазон интересен прежде всего тем, что в этой области излучает СО2-лазер (l = 10600 нм). В силу ряда преимуществ СО2-лазера (см. ниже) и сильного поглощения излучения этого диапазона внутритканевой водой установки на базе СО2-лазеров являются хорошо освоенными на практике «лазерными скальпелями», пригодными для широкого круга хирургических вмешательств.
 |
Результаты хирургического воздействия лазерного излучения на биоткани могут быть достаточно просто оценены визуально и традиционными гистологическими исследованиями. Активное участие в создании и внедрении лазерных хирургических методик приняли многие видные деятели отечественной медицины (А.А. Вишневский, А.И. Головня, А.А. Арапов, Е.И. Брехов и многие другие). Но особенно следует выделить члена-корреспондента РАМН О.К. Скобелкина. Будучи уже сложившимся ученым и хирургом, он целиком посвятил свою деятельность разработке, совершенствованию и внедрению лазерных методик в здравоохранение. Начав с создания лаборатории лазерной хирургии ЦНИЛ Минздрава СССР, он создал и возглавил Институт лазерной хирургии, который был преобразован в Государственный научный центр лазерной медицины Минздрава России, ныне носящий его имя.
Наиболее распространенной из лазерных медицинских технологий является низкоинтенсивная лазерная терапия (НИЛТ). В качестве синонима НИЛТ часто употребляется термин лазерная биостимуляция. Уровень мощности излучения при таких воздействиях находится много ниже уровня нанесения физических изменений (гипертермия, коагуляция, удаление ткани) в биотканях. Однако воздействие лазерного излучения через различные механизмы оказывает системное воздействие на человеческий организм, с которым может быть связан выраженный лечебный эффект.
Интенсивные исследования в отечественной медицине в этом направлении ведутся более 40 лет. В его развитие значительным оказался вклад советских и российских ученых Н.Ф. Гамалея, Л.Я. Мазо, Г.М. Капустиной, И.М. Корочкина, О.К. Скобелкина, Г.И. Клебанова, Т.И. Кару, В.И. Козлова, и других. Особенно следует отметить А.К. Полонского с сотр., показавших в середине 70-х эффективность сочетанного воздействия лазерного излучения и магнитного поля, и положивших начало использованию магнито-лазерной терапии, при которой сочетанное воздействие магнитного поля и лазерного излучения усиливают терапевтический эффект.
В течение долгого времени НИЛТ не признавалась страховой медициной ведущих развитых стран (за исключением Израиля и Японии). Это можно объяснить как недостаточной изученностью механизмов НИЛТ, так и блокированием процесса признания лоббистами фармакологических компаний, которые не без основания видят в этих методиках серьезную конкуренцию фармакологическим методам лечения и опасность снижения своих прибылей. К настоящему времени накоплен большой клинический опыт использования НИЛТ, и это несмотря на то, что механизмы, лежащие в основе его действия пока далеко не изучены. На рубеже столетий произошел прорыв: американская FDA допустила низкоинтенсивную лазерную терапевтическую аппаратуру для использования в клинической практике. Одновременно резко активизировались научные исследования, направленные на определение механизмов НИЛТ.
В аппаратах для НИЛТ используются сравнительно дешевые лазеры с малой мощностью излучения. Не удивительно, что такая аппаратура с близкими характеристиками выпускалась и выпускается большим числом предприятий, в том числе в России. Значительная ее часть получила разрешение МЗ России на клинические применения.
В отличие от НИЛТ, результатом высокоинтенсивной, или силовой лазернойтерапии являются хорошо регистрируемые обратимые или необратимые изменения, происходящие в организме, которые не оставляют характерные для хирургических воздействий деструктивные последствия в виде разрезов, коагулированной или удаленной ткани. К таким воздействиям относятся наблюдаемые при нагреве лазерным излучением обратимая потеря упругости хрящевых тканей, или гибель патологических (в частности, онкологических) тканей. К этой же области может быть отнесена фотодинамическая терапия – ФДТ, при которой за счет воздействия лазерного излучения на введенный в организм фотосенсибилизатор происходит генерация цитотоксических веществ (например синглетного кислорода), в количествах достаточных для лечебного воздействия на очаг патологии.
Прогресс в лазерных медицинских методиках неразрывно связан с совершенствованием техники, необходимой для их реализации.
 |
По времени разработку и производство медицинской лазерной техники в нашей стране можно разбить на два периода. До начала 90-х годов эта аппаратура разрабатывалась на крупных промышленных предприятиях, в первую очередь, Научно-производственном объединении «Полюс». Здесь уместно упомянуть создателя и первого Генерального директора НПО «Полюс» профессора М.Ф. Стельмаха, внесшего значительный вклад в становлении лазерной отрасли промышленности в СССР, и, в частности, в организацию разработок и производства лазерной медицинской аппаратуры.
По его инициативе в НПО «Полюс» было создано первое в СССР подразделение, начавшее разработку лазерной медицинской аппаратуры. Объединение активно участвовало в разработке в содружестве с врачами лазерных медицинских технологий.
В начале 70-х в рамках комплексной долгосрочной программы были разработаны и освоены в серийном производстве под руководством А.И. Ларюшина на Ульяновском радиоламповом заводе (УРЛЗ) НПО «Полюс» первые отечественные лазерные скальпели «Скальпель-1», «Ромашка-1» и «Ромашка-2», до сих пор работающие в клиниках России и стран СНГ. Лазерные хирургические аппараты разрабатывались и выпускались также ГНПП «Исток» (Фрязино), ЛОМО (Ленинград), БелОМО (Минск) в Белоруссии, налажен выпуск офтальмологических лазерных аппаратов на УРЛЗ и Загорском оптико-механическом заводе (Загорск, ныне Сергиев Посад).
Несколько короче перечень выпускавшейся диагностической лазерной аппаратуры. В НПО «Астрофизика» был освоен выпуск лазерного анализатора капиллярного кровотока «ЛАКК-1», в НИИ радиооптики НПО «Вега» был освоен выпуск лазерный анализатор рефракции «ЛАР-1».
Наибольшее количество наименований лазерной аппаратуры было разработано для НИЛТ. В этом отметились большинство ранее перечисленных предприятий и многие другие отраслевые, академические и учебные институты, в том числе МГТУ (тогда МВТУ) им. Н.Э.Баумана.
Серьезным фактором, способствовавшим прогрессу лазерной медицинской аппаратуры и лазерных медицинских технологий, явилось тесное сотрудничество физиков, инженеров и врачей.
С появлением в начале 90-х экономических проблем в стране и распадом СССР централизованное финансирование направления практически прекратилось. Оказались свернутыми или замороженными разработки новых и выпуск серийных лазерных хирургических аппаратов на предприятиях электронной промышленности. Вместе с тем направление не умерло. С новыми разработками лазерных скальпелей и аппаратуры для силовой лазерной терапии на рынке появились предприятия, ранее известные как производители обычного вооружения: тульские КБ приборостроения и «Туламашзавод», московский Федеральный научно-производственный центр «Прибор».
Ситуация объясняется достаточно просто. С одной стороны, электронная промышленность России была брошена на грань выживания (а частью просто обанкрочена). С другой стороны, производители вооружений, получая некоторые средства от экспортных поставок, в связи с сокращением заказов на вооружение, искали перспективные направления для конверсии с учетом имеющегося квалифицированного кадрового состава.
Кроме этого, разработку и выпуск лазерной медицинской техники (в большей степени, простой, терапевтической, в меньшей степени хирургической) начали малые предприятия, организованные наиболее активными и квалифицированными разработчиками, ушедшими из государственных предприятий оборонного комплекса. С одной стороны — поставленные в жесткие условия рынка, с другой — имеющие научно-технический задел, не связанные громоздким административным аппаратом и получившие возможность использования современной импортной элементной базы, эти предприятия наладили выпуск вполне современной аппаратуры, не уступающей зарубежным образцам. Более того, именно благодаря негосударственным предприятиям Россия сохранила свои позиции в разработке медицинских лазеров, как традиционных с ламповой накачкой (ООО «Лаген», ООО «Лагран», ООО «Лартель», ООО «Медоптотех»), так и получивших быстрое развитие в эти годы полупроводниковых (предприятия «Алто», «Алком-Медика», НТО «ИРЭ-Полюс», «МИЛОН-Лазер», «Полупроводниковые приборы»), уступая государственным только в части аппаратов на основе СО2-лазеров. Благодаря НТО «ИРЭ-Полюс» Россия стала мировым лидером в использовании, в том числе и для медицины, волоконных лазеров.
Следует отметить, что именно в эти годы достигнут значительный прогресс в увеличении надежности и уровня выходной мощности полупроводниковых лазеров (лазерных диодов) при снижении их себестоимости. Немного позднее появились лазеры на активированном волокне, способные генерировать излучение мощностью в единицы, а затем десятки и сотни Ватт.
Все это позволило создавать на основе полупроводниковых и волоконных лазеров медицинские аппараты для хирургии и силовой терапии с прекрасными эксплуатационными характеристиками: малыми габаритами, весом (около 10 кг) и энергопотреблением (порядка 100 Вт). Поскольку диодные лазеры можно просто модулировать по питанию, с их помощью легко реализуются различные временные (непрерывный, импульсный и импульсно-периодический) режимы работы.
C появлением современных портативных аппаратов стало возможным, например, разместить в одной эндоскопической стойке несколько недорогих аппаратов, по-разному воздействующих на биоткани. Немаловажно, что благодаря высокой надежности и простоте управления такие аппараты не требуют высококвалифицированного инженерного обеспечения при работе. Аппараты на основе полупроводниковых и волоконных лазеров оказываются дешевле аналогов на основе твердотельных и газовых лазеров. К этому добавляется более низкая стоимость эксплуатации, обусловленная отсутствием периодических профилактических работ.
Появление таких аппаратов позволило создать условия для массового внедрения лазерных технологий в медицину. К сожалению, сочетание низкого уровня финансирования здравоохранения с неэффективной работой медицинской бюрократии не позволило использовать в полной мере существующие возможности. Дополнительным препятствием для внедрения высокоэффективных стационарозамещающих технологий являются действующие нормативы ОМС (обязательного медицинского страхования), по котором уменьшение койко-дней по сравнению с нормативными ведет к финансовым потерям для медицинского учреждения, то есть происходит своеобразное «антистимулирование».
Попутно заметим, что довольно неудачным является термин «лазерная медицина». Он столь же некорректен, как, например термин «скальпельная медицина». Его методический вред заключается в том, что он подталкивает врача к решению всех проблем пациента лазерными методами, тогда как термин «лазерные медицинские технологии» говорит о том, что лазер является, хоть и весьма эффективным, но одним из многих средств в арсенале врача. А врач, в свою очередь, должен в зависимости от стоящей перед ним лечебной задачи выбирать самое эффективное в каждом конкретном случае средство: обычный скальпель, лазерный, плазменный, ультразвуковой, электрокоагулятор и, т.п., либо обойтись вообще без хирургического вмешательства.
Необходимым условием успешного использования лазерных медицинских аппаратуры и технологий и, особенно, их разработки требует знаний физических процессов, происходящих в лазерах, технических особенностей различных типов лазеров, физических и физиологических процессов, происходящих при взаимодействии лазерного излучения с биообъектами. Основы этих знаний и призван заложить данный курс.
Рассмотрим некоторые характерные примеры эффективного использования современной лазерной медицинской аппаратуры.
Наиболее быстро новые аппараты получили признание в оториноларингологии (см. напр. [5]). Причем наряду с хирургическим воздействием, лазерные аппараты оказались весьма эффективными для такого вида силовой лазерной терапии, как лазерная термопластика хрящей [6]. В основе этой методики лежит способность хрящевой ткани обратимо менять свою упругость при нагреве до температуры около 70° С. Этот метод может быть использован для коррекции формы носовой перегородки, крыльев носа и ушных раковин. При осуществлении процедуры с помощью лазерного излучения через слизистую осуществляют нагрев хряща перегородки с фиксацией желаемой формы до остывания после прекращения действия лазерного излучения. При этом хрящ перегородки восстанавливает свою упругость, и перегородка принимает новую форму. Процедура практически безболезненна, может проводиться в амбулаторных условиях и заменяет традиционную малоприятную и болезненную операцию, требующую достаточно продолжительной госпитализации. Более того, щадящее воздействие позволяет сохранить центры роста в хряще, что позволяет выполнять указанную процедуру детям.
С помощью полупроводниковых и волоконных лазерных аппаратов удалось реализовать [7] новый подход к лечению ЛОР патологий с использованием симультанных (симультанными считают операции, проводимые одномоментно на двух или более органах по поводу различных заболеваний) эндоскопических операций. Это стало возможным благодаря тому, что операции с применением лазерного излучения протекают бескровно, с малыми отеками. Малая болезненность лазерного воздействия позволяет использовать минимальную анестезию. Благодаря эндоскопической технике и точному дозированию лазерного излучения операции выполняются малоинвазивно и послеоперационные раны быстро заживают. Поскольку осуществляется одновременное лечение всех очагов инфекции в носоглотке, резко снижается вероятность рецидивов, а послеоперационное лечение осуществляется с минимумом лекарственных средств, как правило, без антибиотиков. Использование лазерной термопластики хрящей для коррекции формы носовой перегородки позволяет улучшить аэродинамику носа и вентиляцию пазух, что также способствует ускорению излечения.
Необходимо отметить, что при хирургическом лечении пациентов без госпитализации особенное внимание должно быть уделено инструктажу пациентов относительно послеоперационного лечения, включая порядок действий в случае экстренных обстоятельств, например, при внезапно начавшемся кровотечении. Кроме этого, опыт показывает, что результаты лечения бывают настолько разительны, что пациенты могут переоценить свое состояние, не довести амбулаторное лечение до конца и неосторожно обращаться со своим здоровьем, что особенно свойственно подросткам и молодым людям.
Не менее эффективно используется в ЛОР-практике излучение с длиной волны 1,56 мкм (см. напр. [6,8]). Благодаря большему (по сравнению с 0,976 мкм) поглощению в воде и меньшему в крови, при использовании этой длины волны для лазерной термопластики носовой перегородки удается уменьшить тепловое поражение слизистой. Наиболее универсальным для ЛОР применений оказался аппарат ЛСП-«ИРЭ-Полюс» с двумя независимо регулируемыми рабочими излучениями 0,97 и 1,56 мкм, выводимыми в одно рабочее волокно.
Все шире используются впрактике такие методы силовой лазерной терапии, как лазерная интерстициальная термотерапия (ЛИТТ) и фотодинамическая терапия (ФДТ). ЛИТТ — метод подавления опухолей путем теплового воздействия на клетки, при котором цитотоксическое воздействие достигается за счет нагрева биоткани поглощаемым лазерным излучением. Классическая гипертермия злокачественных опухолей заключается в нагреве зоны опухоли до температуры 42,5-45°С, при которой раковые клетки погибают, а повреждение здоровых обратимо. Эффект носит ярко выраженный дозозависимый характер, т.е. перегрев приводит к гибели здоровых тканей, а недогрев может привести к росту опухоли и метастазированию. Использование лазерного излучения упрощает достижение результата. Излучение вводится внутрь опухоли по световоду, оканчивающемуся специальным наконечником (диффузором), рассеивающим мощность в окружающие ткани. При этом условия, гибельные для раковых и переносимые для здоровых тканей, нужно создать на границах опухоли, тогда как вблизи диффузора ткань может перегреваться даже до температуры коагуляции. Благодаря этому возможно использовать ЛИТТ для лечения доброкачественных опухолей, например миом матки [9]. Поскольку требуется объемный нагрев биоткани, используется глубоко проникающее излучение (длины волн 0,81 и 1,06 мкм).
В ФДТ, первоначально разрабатывавшейся как метод лечения злокачественных опухолей, цитотоксическое действие осуществляется за счет воздействия синглетного кислорода, выделяемого при воздействии лазерного излучения на введенный в биоткань сенсибилизатор. Эта методика в настоящее время успешно используется не только для лечения доброкачественных и злокачественных опухолей, но также при лечении раневых процессов, и различных заболеваний (кожи, ЛОР–органов). Наиболее перспективными для использования в ФДТ представляется в настоящее время излучение с длиной волны 0,66-0,67 мкм в сочетании с новым хлоропорфириновыми фотосенсибилизаторами типа «Радахлорина» [10], менее токсичными по сравнению с аналогичными препаратами предыдущих поколений, быстро накапливающимися в опухоли и быстро выводящимися из организма.
Исследования показали, что ФДТ оказывается эффективным методом лечения и различных воспалительных патологий. Она успешно используется, например, при лечениях гайморита. Метод лечение весьма распространенных воспалительных заболеваний полости рта с применением ФДТ получил название «бактериотоксическая терапия» [11].
Практически при всех применениях лазеров в сочетании с современной эндоскопической техникой и пункционными методиками удается уменьшить травматичность операционного вмешательства, сократить сроки излечения, снизить вероятность послеоперационных осложнений. Немаловажно для удобства работы то, что аппараты хорошо встраиваются в стандартную эндоскопическую стойку, удобны при работе в рентген-операционных и с УЗИ контролем.
Лазерные скальпели с длиной волны 0,976 мкм хорошо зарекомендовали себя при малоинвазивных лапароскопических операциях [12]. Общее число прооперированных пациентов, прооперированных в Московской ДГКБ №20 им Тимирязева (Л.М. Рошаль с сотр.) превысило 500 чел. При этом были отмечены только два осложнения, выразившихся в интраоперационных кровотечениях, ликвидированных в ходе операций с помощью лазерного излучения.
Аппараты успешно используются и для лечения урологических заболеваний [13]. В частности, лазерный аппарат с длиной волны 0,976 мкм и выходной мощностью до 30 Вт не только успешно использовался при операциях по поводу доброкачественной гиперплазии мочевого пузыря и коагуляции поверхностного рака мочевого пузыря, но и достаточно эффективно разрушал камни в мочевом пузыре при контактном возд
| <== предыдущая лекция | | | следующая лекция ==> |
| Программирование под Windows с использованием MFC Документ и его представления | | | Спонтанное и вынужденное излучение. |
Дата добавления: 2017-01-26; просмотров: 3161;











