Раковые супрессорные гены.
Эти гены обычно доминантны по отношению к ПО. Мутация, которая инактивирует один аллель, может привести к трансформации. Опухоли могут образовываться по другому механизму: потери двух аллелей в локусе онкогенности. Мутации могут наследоваться через половые клетки, либо быть результатом соматических изменений. Развитие рака происходит из-за потери функции РСГ. Наиболее охарактеризованными РСГ являются р53 и Rb.RB белок
Ретинабластома - рак сетчатки, встречающийся у детей. Он передается по наследству, либо возникает спорадически. Заболевание связано с инактивацией обеих копий гена Rb и, как следствие, с отсутствием в клетке белкового продукта. Инактивация происходит в результате делеции локуса q14 тринадцатой хромосомы, несущего данный ген. Признак является рецессивным и проявляется в потомстве, если оба родителя несут хотя бы по одной инактивированной копии гена. Ненаследственная форма ретинобластомы крайне редка, так как для ее возникновения необходимо произойти мутациям в обеих копиях гена Rb. Кроме ретинобластомы инактивация Rb вызывает многие опухоли легких, мочевого пузыря и молочной железы. Как уже упоминалось выше, инактивация Rb на белковом уровне может осуществляться продуктами генов раковых вирусов, таких как SV40, аденовирус и вирус папилломы.Rb является фосфопротеином, играющим важную роль в регуляции перехода клетки из G1 в S фазу (Рис. 31 ).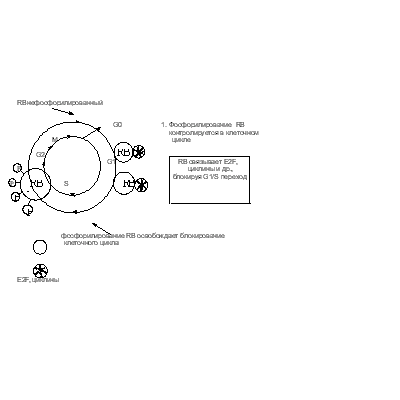 Рис. 31. Белок RB в регуляции клеточного деления Центральную роль в этом переходе играет E2F, фактор транскрипции некоторых генов, необходимых для синтеза ДНК в S фазе. Он так же стимулирует транскрипцию генов циклина А, циклина Е и своего собственного гена. Белок pRb ингибирует E2F, связываясь с последним в G1 фазе. Факторы роста стимулируют транскрипцию циклина D. Происходит накопление комплексов циклин D - Cdk4, которые начинают фосфорилировать Rb, что приводит к его диссоциации от E2F. Высвободившийся E2F стимулирует транскрипцию своего гена и гена циклина Е. Образующийся вследствие этого комплекс CDK2-цЕ, еще активнее фосфорилирует pRb. Таким образом, сеть эффектов через петлю положительной обратной связи приводит к быстрому возрастанию E2F зависимой транскрипции и переходу клетки в начало S фазы. В конце митоза рRb дефосфорилируется. Переэкспрессия Rb препятствует клеточному росту. Это продемонстрировано на примере клеточной линии остеосаркомы, которая потеряла этот ген. При внесении гена Rb в культуру ее рост прекращается. Были обнаружены сходные с Rb белки, способные взаимодействовать с другими представителями семейства факторов транскрипции E2F.
Рис. 31. Белок RB в регуляции клеточного деления Центральную роль в этом переходе играет E2F, фактор транскрипции некоторых генов, необходимых для синтеза ДНК в S фазе. Он так же стимулирует транскрипцию генов циклина А, циклина Е и своего собственного гена. Белок pRb ингибирует E2F, связываясь с последним в G1 фазе. Факторы роста стимулируют транскрипцию циклина D. Происходит накопление комплексов циклин D - Cdk4, которые начинают фосфорилировать Rb, что приводит к его диссоциации от E2F. Высвободившийся E2F стимулирует транскрипцию своего гена и гена циклина Е. Образующийся вследствие этого комплекс CDK2-цЕ, еще активнее фосфорилирует pRb. Таким образом, сеть эффектов через петлю положительной обратной связи приводит к быстрому возрастанию E2F зависимой транскрипции и переходу клетки в начало S фазы. В конце митоза рRb дефосфорилируется. Переэкспрессия Rb препятствует клеточному росту. Это продемонстрировано на примере клеточной линии остеосаркомы, которая потеряла этот ген. При внесении гена Rb в культуру ее рост прекращается. Были обнаружены сходные с Rb белки, способные взаимодействовать с другими представителями семейства факторов транскрипции E2F.
Белок р53
Р53 - раковый супрессорный ген. Он получил свое название по молекулярной массе белкового продукта. Ген наследуется как аутосомная доминанта при синдроме Ли-Фраумени - редкой форме наследственного рака. У больных этим синдромом развивается рак различных органов, что связано с мутациями в гене р53. Изучение этих мутаций открыло новые свойства р53 и объяснило его связь с возникновением рака.P53 - ядерный фосфопротеин, который открыли в SV40 трансформированных клетках, в которых он связан с Т-антигеном. Повышенная экспрессия р53 была обнаружена во многих раковых клеточных линиях. В ранних экспериментах вставка клонированного р53 была найдена в иммортализованных клетках, в связи с чем его назвали онкогеном с обычной доминантной функцией. Но все трансформирующие формы р53 выключались в мутантных формах белка. И тогда они попали в категорию доминантных негативных мутантов, которые функционируют через подавление функции в диком типе. Наиболее общее формой доминантного негативного мутанта является та, которая формирует гетеродимерный белок, объединяющий субъединицу мутировавшего и дикого типа, в котором субъединица дикого типа не функционирует. Вероятно, р53 существует как тетрамер.Трансформированный фенотип образуется либо делецией обоих аллелей или точечной мутацией в одном из аллелей, которая продуцирует доминантный негативный фенотип . Обе ситуации найдены в раковых опухолях человека. Мутации р53 накапливаются во многих во многих типах рака человека, вероятно из за того, что потеря р53 стимулирует рост клетки, а для остановки роста нужен дикий тип р53. Многообразие видов рака дает основания предполагать, что р53 не тканеспецифичен, то есть он вовлечен в общий контроль пролиферации и потеря этого контроля может быть вторичным событием, которое стимулирует рост многих опухолей. Такая интерпретация предполагает, что нормальные клетки растут в сдержанной манере, которая обычно ингибируется р53. Какова функция р53 на молекулярном уровне? р53 был открыт как белок, связывающийся с большим Т-антигеном вируса SV40. В отличие от дикого типа, мутантные формы белка не способны связывать Т- антиген. Связывание дикого типа р53 с Т-антигеном коррелирует с его способностью стимулировать репликацию вируса. Одна возможность - р53 дикого типа связывается с клеточными аналогами Т-антигена, при этом ингибируется активность последнего. У мутантных форм такая способность теряется. Белок р53 является ДНК связывающим белком, узнающим специфичный мотив из 10 п.о. в активном промоторе, который содержит этот мотив. Для некотоых генов р53 может быть супрессором. р53 также регулирует экспрессию генов, контролирующих клеточный цикл. Этот белок связывается с последовательностью ДНК PuPuPuC(A/T)(T/A)GpyPyPy, которая содержится в некоторых промоторах. Сам белок р53, состоящий из 392 аминокислот, состоит из шести доменов: 1.N-концевой домен (1-50 амк.) вовлечен в транскрипционную активацию генов-мишеней (р21- ингибитор Cdk и другие гены, участвующие в остановке клеточного цикла, GADD45, 14-3-3-d, Bax). Он же ответственен за взаимодействие с Mdm2 - ингибитором р53. В этом участке находятся 7 остатков серина и треонина, являющиеся мишенями для киназ. 2.Дополнительный транскрипционный домен (43-73 амк.) для активации генов-мишеней. 3. Гибкий пролин-богатый домен (73-97амк.), в котором выявлены элементы РххР, важен для полного проявления супрессорной активности. Участвует в запуске апоптоза. Мишени - TBP, TFIID, SpII, HIF-1, STAT-5, Bcl-2, MDR-1, рецептор тироидного гормона. 4. Центральный домен (100-300 амк.), который узнает специфические последовательности ДНК. Именно в этом районе обнаружено большинство мутаций в раковых опухолях. 5. Участок, отвечающий за ядерную локализацию р53 (305-323амк.).альфа-спираль - участок, отвечающий за тетрамеризацию (323-356амк.). 6. Основный домен (363-392амк.) является мишенью для модифицирующих ферментов (киназ, ацетилаз, гликозилаз). В немодифицированной форме он препятствует образованию комплекса с ДНК. Кроме того, С-конец может может неспецифически связываться с одноцепочечной ДНК, непарными основаниями и концама ДНК, что указывает на его участие в узнавании повреждений ДНК и запуске репарации.Р53 называют "стражем генома". Он активируется в ответ на различные виды стресса и останавливает пролиферацию, а вслучае более серьезных повреждений запускает программу апоптоза - гибели клетки. Около 50% опухолей человека имеют дефектный р53. Большинство мутаций р53 возникает в позициях, где аминокислоты высококонсервативны. Это предполагает, что эти мутации связаны с консервативными функциями. Охарактеризованные мутации р53 вызывают эффекты, связанные с изменениями свойств белка, включая его время полужизни от 20 минут до нескольких часов, изменения его конформации, изменения его клеточной локализации от ядерной к цитоплазматической, изменения способности связываться с ДНК или Т-антигеном. Такая плейотропность делает затруднительным определить, какой из них связан с супрессией рака. Кроме Rb и р53 существует множество других генов супрессоров опухолей. В частности, к ним относятся р21, p16 и р27 - ингибиторы Cdk, которые будут рассмотренные в следующей главе, WT1 - супрессор транскрипции некоторых факторов роста и онкогенов bcl-2 и c-myc, NF1 - подавляет активность ras за счет активации ГТФаз.Дата добавления: 2019-09-30; просмотров: 746;











