Получение культуры каллуса, суспензионных культур и одиночных клеток.
Основным типом поверхностно культивируемых растительных клеток является каллусная, значительно реже культивируют клетки опухолевых тканей растений.
Классическая каллусная культура, выращиваемая поверхностным способом, (первичный каллус) представляет собой аморфную, рыхлую массу сильно оводненных дедифференцированных клеток, не имеющую определенной анатомической структуры, цвет которой может быть белым, желтоватым, зеленым, красным. Такая рыхлая каллусная ткань легко распадается на небольшие группы клеток и кластеры и поэтому может быть использована для получения суспензионной культуры. Под влиянием фитогормонов клетки первичного каллуса могут претерпевать процессы вторичной (обратно) дифференцировки и органогенеза, что существенно сказывается на внешнем виде и консистенции (плотности) каллуса. Так каллусная культура средней плотности уже характеризуется хорошо выраженными меристематическими очагами. В ней легко инициируются процессы органогенеза. Наконец, у плотных каллусных тканей различают зоны редуцированного камбия и трахеидоподобных элементов, которые могут дать начало целым растениям.
Культуры опухолевых клеток при глубинном и поверхностном выращивании внешне и по морфологии клеток мало отличаются от культур каллусных клеток. Главным отличием опухолевых клеток является их гормональная независимость, что обеспечивает им неограниченный рост на питательных средах без добавок фитогормонов или их аналогов. Кроме того, опухолевые клетки лишены способности давать начало организованным структурам, таким, как корни или побеги в процессе органогенеза, т.е. не являются тотипотентными. Каллусные клетки в культуре иногда могут спонтанно приобретать гормононезависимость, природа которой может быть следствием мутации или результатом экспрессии генов, определяющих независимость клетки от гормонов. Потеря гормонозависимости приводит к тому, что такие клетки не могут претерпевать вторичную дифференцировку, что не позволяет использовать такие клеточные культуры для получения вторичных метаболитов
В естественных условиях каллусная ткань может возникнуть у растений в результате механических повреждений. Она функционирует непродолжительное время, защищая растение в участке повреждения и накапливая питательные вещества для регенерационного процесса.
Методика искусственного получения каллусной культуры у растений хорошо отработана и не вызывает затруднений. Для того чтобы получить культуру ткани, из любой части растения (стебель, лист, элемента цветка, корень и т.д.), вычленяют эксплантат (кусочек ткани размером 0,5 - 1,0 см), стерилизуют его и помещают на питательную среду определенного состава.
Важнейшую роль в индуцировании каллусообразования на эксплантатах является наличие в питательных средах специфических фитогормонов – ауксинов и цитокининов. Функции этих двух групп фитогормонов в каллусогенезе различны, но они тесно связаны между собой. Ауксины вызывают процессы дедифференцировки и последующей вторичной дифференцировки клеток и подготавливают их к делению, а цитокинины инициируют деление. Во время процесса дедифференцировки, который у всех клеток сходен, клетки должны утратить характерные, индивидуальные черты исходной ткани (потерять некоторые органеллы, в частности хлоропласты и некоторые запасные вещества, такие как крахмал, некоторые белки и липиды).
Различные типы фитогормонов, и, прежде всего их соотношение в среде культивирования, играют определяющую роль и во вторичной дифференцировке каллусных клеток.
Через несколько дней на изолированном кусочке ткани растения образуется первичный каллус. Периодически в асептических условиях его отделяют и переносят на свежую питательную среду для дальнейшего роста. Такую ткань можно поддерживать в культуре неограниченно длительное время, периодически расчленяя ее и пересаживая на свежую питательную среду. Рост пересаженных тканей происходит в контролируемых условиях при температуре 24-28°С.
Формирование каллуса длится обычно 1-2 месяца. Периодичность субкультивирования тканей зависит от скорости роста биомассы. Внешне такая ткань совершенно не похожа на растение, от которого она была получена, но ее клетки несут генетическую информацию, свойственную данному виду. Процессы, происходящие в культивируемых тканях, в принципе не отличаются от идущих в тканях целого растения. Сохранение способности к синтезу специфических вторичных метаболитов - алкалоидов, эфирных масел, карденолидов, стероидов и др. - определяет практическую ценность культур растительных тканей для создания технологий промышленного выращивания биомассы клеток в качестве принципиально нового вида лекарственного сырья. Кроме того каллусные клетки сохраняют свойство тотипотентности, что используется в технологии моноклонального размножения растений.
Другим вариантом культивирования растительных клеток является суспензионная культура, которую выращивают в жидкой питательной среде, по аналогии с процессом глубинного культивирования в промышленной микробиологии.
Культивирование клеток растений в жидкой среде имеет ряд преимуществ перед выращиванием поверхностным способом каллусных культур. В условиях глубинного культивирования значительно легче контролировать метаболизм и рост клеточных популяций с помощью различного рода экзогенных факторов. Суспензионные культуры намного удобнее для биохимических и молекулярно-биологических экспериментов – изучения индукции ферментов, процессов экспрессии генов, изолирования и характеристик получаемых мутантов и т. п.
Клеточные суспензии образуются как из каллусных тканей, так и непосредственно из экспланта. Для получения суспензионных культур пред-почтительнее брать каллусы рыхлого типа. Если для этой цели необходимо использовать плотный каллус, то его можно разрыхлить, исключив из питательной среды соли Са2+. С этой же целью можно культивировать ткань на среде, содержащей ауксин 2-4-дихлорфеноксиуксусную кислоту (2,4-D) или ферменты - пектиназу (0,2 мг/л) и целлюлазу (0,01 мг/л). Наилучший эффект достигается при добавлении ферментов. Суспензионные культуры клеток можно получить и непосредственно из экспланта по методу Ф. Стюарда. Для этого эксплант помещают в жидкую среду при постоянном автоматическом перемешивании. Дедифференцированные клетки отрываются от экспланта, образуя в питательной среде суспензию, состоящую из клеточных агрегатов различного состава. Качество суспензии определяется степенью агрегированности. Агрегаты должны содержать не более 10-12 клеток. Состояние клеточных суспензий характеризуется плотностью клеточной популяции. За 14 - 16 дней (средняя длительность культивирования) плотность обычно повышается от 5•104 до 5х106 кл/мл.
Постоянное встряхивание - необходимое условие культивирования клеточных суспензий. Суспензионные клетки делятся в присутствии тех же двух групп гормонов (ауксинов и цитокининов), которые индуцируют деление клеток в каллусных тканях. Следовательно, можно сказать, что суспензионные культуры представлены разными агрегатами каллусных клеток.
Клеточные суспензии играют значительную роль в биотехнологии. Их культивируют в больших количествах для получения вторичных метаболитов, выявления новых веществ, для выращивания клеточной биомассы. Однако увеличение клеточной биомассы в результате деления клеток и синтез вторичных метаболитов разобщены во времени. Поэтому необходимо хорошо знать физиологию, свойства клеток в суспензионных культурах, чтобы получить максимальный выход продукта.
Большой интерес представляет культура одиночных клеток. Ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Однако культивирование одной или нескольких клеток связана с определенными трудностями, состоящими в том, что одиночная клетка живет, но не делится в тех условиях, которые разработаны для нормального роста и размножения клеток каллусной ткани. Поэтому при культивировании одиночных клеток потребовалась выработка специальных методов. Все они основаны на использовании так называемого «кондиционирующего фактора» - совокупности метаболитов, выделяемых в среду делящимися клетками. Когда на питательную среду высаживается одна клетка или небольшое их количество, они не делятся, так как выделяемого кондиционирующего фактора не хватает для индукции деления. Следовательно, необходимо повысить концентрацию фактора в питательной среде. Этой цели служат следующие методы:
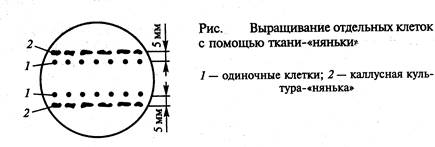
1. Метод ткани-«няньки» — кондиционирующий фактор выделяется находящимися рядом с одиночной клеткой кусочками ткани-«няньки» (рис. ).
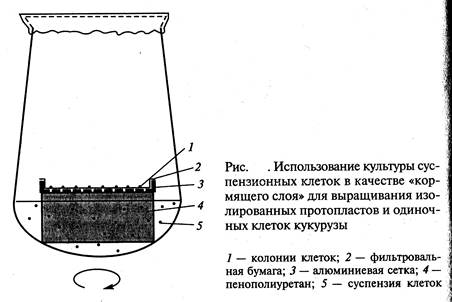
2. Метод «кормящего слоя» - кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка (рис. ).
3. Кондиционирование среды - осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток.
4. Метод культивирования одиночных клеток - осуществляется в микрокапле, т.е. в очень малом объеме (-20 мкл) богатой питательной среды.
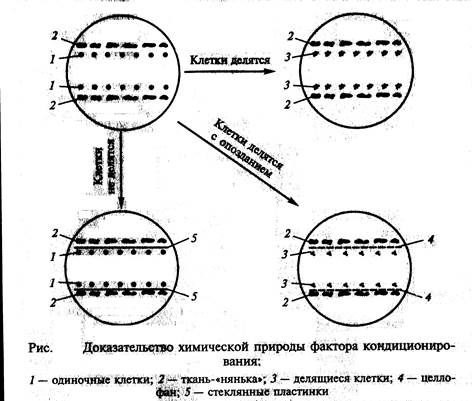
Точно сказать, что представляет собой кондиционирующий фактор, пока невозможно. Согласно исследованиям), этот фактор водорастворим, термостабилен, не заменяется фитогормонами, включает низкомолекулярные вещества. Химическая природа кондиционирующего фактора доказывается с помощью довольно простого эксперимента. Если разделить одиночные клетки и ткань-«няньку» стеклянной пластиной, то деления клеток не наступает. Если вместо пластин поместить микропористый целлофан, то хотя и с задержкой начинается деление одиночных клеток (рис. ).
Клетки животных так же способны расти либо в виде суспензий, либо прикрепленными к плотному субстрату (твердой поверхности). Такие клетки как, HeLa (клетки, происходящие из опухоли человека) могут расти в любом из этих состояний неограниченно долго; лимфобластомные клетки растут в суспендированных культурах; а нормальные диплоидные клетки способны расти только будучи прикрепленными к твердой поверхности и в виде монослоя (монослойное культивирование). Как только вся поверхность будет покрыта клетками, развитие культуры резко тормозится (контактное торможение), снижается синтез целевых метаболитов и происходит перерождение или отмирание клеток. Для предотвращения этих нежелательных процессов приходится периодически проводить пересев (перевивку) культуры на свежую питательную среду и новую поверхность. При этом нормальные (неопухолевые) клетки могут выдерживать от 20 до 50 делений и далее подвергаются дегенерации и погибают.
Монослойное культивирование животных клеток во многом определяется доступностью поверхности для их прикрепления, вследствие чего многие конструкторские разработки направлены на создание методов увеличении возможной площади прикрепления. Ранние технологии основывались преимущественно на использовании вращающихся пробирок или флаконов с целью лучшего обеспечения растущих клеток питательными веществами и воздухом.
Создаваемые в последнее время системы предназначаются для поддержания роста клеток на свернутых в виде "бухт" проницаемых для газов тефлоновых трубочках, каждая из которых имеет поверхность около 10 000 см2 (а общее их число в реакторе более 20). В таких условиях многие типы клеток культивируются довольно хорошо. Еще одним перспективным способом культивирования клеток животных является способ, основанный на использовании небольших бусин (шариков, микроносителей), к которым прикрепляются клетки. Шарики могут изготавливаться из сефадекса (химически модифицированный крахмал) и обладать поверхностью в 7 см2 на 1 мг. Шарики способны плавать в суспендированном состоянии и на них могут расти клетки различных типов. Таким путем уже получают человеческий интерферон. Данный способ, полагают, способен заменить метод монослойных культур.
В отличии растений культивирование фрагментов или целых органов животных представляет значительно более сложную задачу. Это связано с тем, что очень сложно создать для них необходимые условия из - за повышенной потребности в питательных веществах и кислороде. Так кусочки печени растут в питательной среде при содержании в газовой фазе 95% О2 и 5%СО2. Длительное культивирование целых взрослых органов пока представляет собой неразрешимую задачу. Гораздо легче удается культивировать различные эмбриональные органы и их фрагменты. Особенно перспективным представляется в настоящее время культивирование так называемых стволовых клеток (аналоги меристемных клеток растений).
Дата добавления: 2017-01-26; просмотров: 3600;











