Электролиты. Электролиз. Законы Фарадея для электролиза.
Хорошими проводниками является не только металлы, но и растворы электролитов.
Электролитами называются вещества, растворы которых проводят электрический ток. Попадая в раствор, молекулы электролита распадаются на ионы.
Процесс распада молекул электролита на ионы в растворителе называется электролитической диссоциацией.
Обратный процесс называется рекомбинацией. Однако в растворе всегда имеется некоторая часть свободных ионов электролита. Количественно их количество определяется степенью диссоциации вещества:
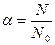 ;
;
где N – число ионизированных распавшихся молекул, N0- полное количество молекул электролита.
Таким образом, выполнено 1 условие существования электрического тока.
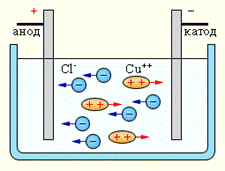
Для выполнения 2-го условия поместим в раствор 2 электродами и подключим их к источнику тока (рис.6 ).
Под действием электрического поля ионы движутся к электродам и, достигая, где и оседают.
Процесс выделения на электродах веществ, входящих в состав электролита под действием электрического поля называется электролизом.
 Масса вещества выделяющегося на электродах при электролизе определяется законами Фарадея для электролиза:
Масса вещества выделяющегося на электродах при электролизе определяется законами Фарадея для электролиза:
I закон Фарадея: масса вещества выделившегося при электролизе пропорциональна заряду, прошедшего через раствор электролита
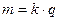
II закон Фарадея: электрохимический эквивалент вещества пропорционален его химическому эквиваленту
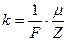 ,
,
Рис. 6где 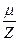 - химический эквивалент; F - постоянная Фарадея:
- химический эквивалент; F - постоянная Фарадея: 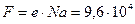 Кл/моль.
Кл/моль.
Электролиз имеет достаточно широкое практическое применение:
- для создания защитных от коррозии покрытий
- для выделения веществ из смеси;
- для воспроизведения рельефных покрытий;
- при использовании гальванических элементов питания (аккумуляторов).
6. Самостоятельный и несамостоятельный газовый заряд. Вольт-амперная
характеристика газового заряда. Виды газового разряда.
Молекулы газов электрически нейтральны, поэтому газы являются диэлектриками.
Однако при воздействии на газы, например, его молекулы теряют электроны и становятся ионами – ионизируются. Параллельно идет процесс рекомбинации.
Долю ионизированных атомов вещества характеризует степень ионизации:
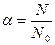 .
.
Для создания электрического тока газ помещают в сосуд с 2 электродами, подключенными к источнику тока, называемой газоразрядной трубкой.
Электрический ток в газах называется газовым разрядом.
Газовый разряд называется несамостоятельным, если после устранения внешнего ионизатора ток прекращается.
Зависимость силы тока в газе от напряжения на электродах трубки называется вольт-амперной характеристикой газового разряда.
1. {ОА} – линейный участок
2. {АВ} – область насыщения
3. {ВС} – область ударной ионизации.
Обозначим энергию необходимую для ионизации газа  . Тогда чтобы электрон смог ионизировать атом его кинетическая энергия должна быть не меньше
. Тогда чтобы электрон смог ионизировать атом его кинетическая энергия должна быть не меньше  . Необходимую кинетическую энергию электрону сообщает электрическое поле, совершая при этом работу
. Необходимую кинетическую энергию электрону сообщает электрическое поле, совершая при этом работу  .
.
Разность потенциалов 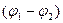 , обеспечивающая ионизацию атомов газа, называется ионизационным потенциалом:
, обеспечивающая ионизацию атомов газа, называется ионизационным потенциалом:
 .
.
При выполнении данного условия, даже в отсутствии внешнего ионизатора газовый разряд не прекратится.
Такой газовый разряд называется самостоятельным.
Примеры газовых разрядов:
- тлеющий – лампа дневного света;
- дуговой – сварка;
- искровой – молния.
Дата добавления: 2017-01-16; просмотров: 2154;











