ОБЩАЯ ХАРАКТЕРИСТИКА АНТИТЕЛ.
Антитела — белки, относящиеся к тому или иному классу иммуноглобули-нов, синтез которых стимулируется после парентерального поступления антигена; антитела обладают способностью специфически взаимодействова-ть с данным антигеном.
Благодаря последнему качеству антитела являются одним из основных специфических факторов иммунитета, направленных именно против той чужеродной субстанции, которая была причиной их возникновения.
Известны пять классов иммуноглобулинов: IgM, IgG, IgA, IgE и IgD.
Суммарное количество иммуноглобулинов в сыворотке крови составляет около 2,5 % (сухой остаток), т. е. более 1/3 всех белков.
Антитела вырабатываются клетками лимфоидных органов, циркулируют в крови и других жидкостях организма. Антитела определенного типа, так называемые секреторные иммуноглобулины класса А, выходят за пределы слизистых оболочек в просвет кишечника, дыхательных путей и др., являясь «первой линией обороны» организма.
Антитело (АТ) — гликопротеин, относящийся к классу Ig. АТ специфически взаимодействует с комплементарным Аг. АТ существуют в миллионах разновидностей, и каждая молекула имеет уникальный участок связывания антигенной детерминанты. АТ синтезируют плазматические клетки в ходе гуморального иммунного ответа. Ig образуют один из основных классов белков крови, составляя 20% массы белка плазмы. Гены кодирующие синтез известных классов Ig, расположены в хромосомах 2, 14 и 22.
Структура. Молекулы иммуноглобулинов разных классов построены из одних и тех же мономеров, имеющих по две тяжелых и по две легких цепи.
Молекула Ig состоит из двух лёгких цепей (L-цепи) и двух тяжёлых цепей (Н-цепи). В цепях различают вариабельную область (V-область) в N-концевой части и постоянную, или константную область (С-область). V-область у разных АТ варьирует. V-области L- и Н-цепей образуют Аг - связывающий центр, или Fab-фрагмент. Константная область молекулы Ig имеет Fс - фрагмент.
Аг- связывающий центр образован вариабельными областями L- и Н-цепей. С Аг-связывающим центром взаимодействует антигенная детерминанта (эпитоп) иммуногена.
Fс - фрагмент определяет специфичность связывания молекулы Ig с клетками-эффекторами (например, макрофаги, полиморфно-ядерные лейкоциты, тучные клетки), несущими на своей поверхности рецепторы Fс-фрагмента.
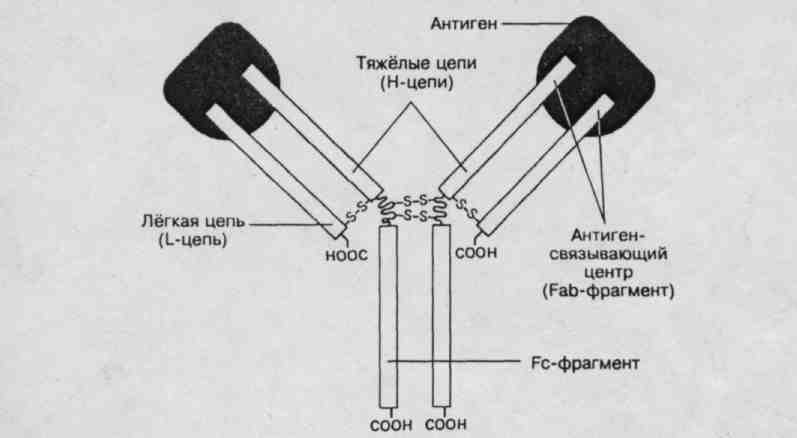
рис. 1. Структура иммуноглобулина. Молекула состоит из двух идентичных тяжёлых (Н) и двух идентичных лёгких (L) цепей. N-концевые области L- и Н-цепей образуют два Аг-связывающих центра. Fс-фрагмент молекулы взаимодействует со своим рецептором в мембране различных типов клеток (макрофаг, нейтрофил, тучная клетка).
ДИНАМИКА ПРОДУКЦИИ АНТИТЕЛ.
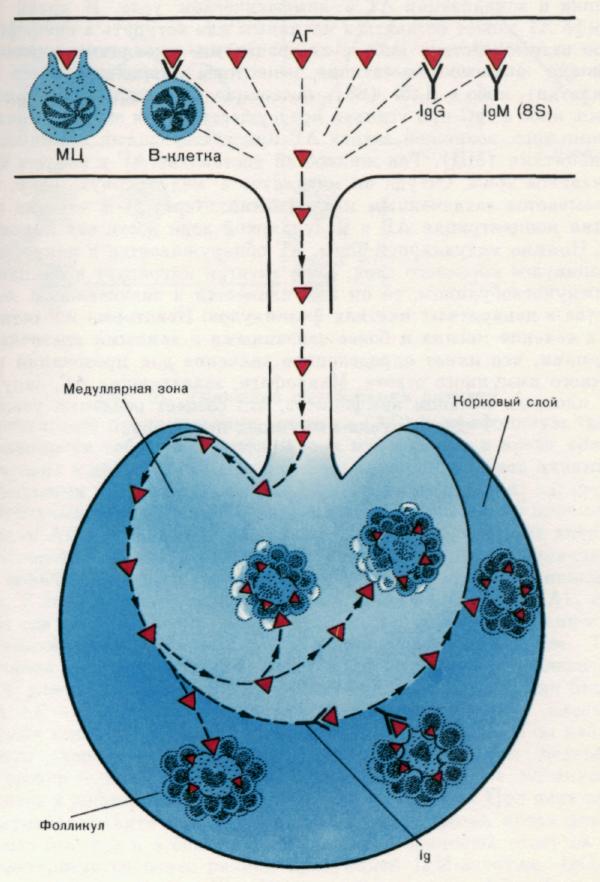
Рис. 2. Локализация антигена в лимфатическом узле.
Накопление антигена (АГ) в тех или иных органах лимфо - миелоидного комплекса зависит от способа проникновения АГ в организм.
1. При попадании непосредственно в кровь АГ в значительных количествах концентрируется в селезенке.
2. При подкожном введении АГ достигает ближайшие лимфатические узлы через кровеносные и лимфатические сосуды. На рисунке показан способ доставки и локализации АГ в лимфатическом узле. В крови или лимфе АГ может оставаться нативным или вступать в специфическое взаимодействие либо с лимфоцитами, имеющими соответсвующие антигенсвязывающие рецепторы (вероятнее всего это В-клетки), либо с IgМ, постоянно секре-тируемым В-клетками, либо с IgG при условии предсуществования его в организме. Кроме того, возможен захват АГ присутствующими в жидкостях моноцитами (МЦ). Ток жидкостей доставляет АГ в синусы маргинальной зоны. Оттуда он мигрирует в медуллярную зону, где оказывается захва-ченным макрофагами.
Через 1—2 ч после введения концентрация АГ в медуллярной зоне достигает максимума. Помимо медуллярной зоны, АГ обнаруживается в макрофагах фолликулов коркового слоя. Если антиген мигрирует в комплексе с иммуно-глобулином, то он накапливается в значительном количестве в дендритных клетках фолликулов. Некоторые АГ остаются в течение месяца и более связанными с данными клеточными формами, что имеет определенное значение для провокации вторичного иммунного ответа. Макрофаги, захватившие АГ, окружены плотным кольцом лимфоцитов, что создает реальные условия для запуска иммунных процессов.
Классы Ig. В зависимости от структуры Н-цепей, выделено пять разных классов (изотипов) АТ — Ig А, Ig D, Ig Е, Ig G и Ig М.
Разные классы иммуноглобулинов отличаются друг от друга биологическими свойствами. Прежде всего это относится к их способности связывать гомологичные антигены. В данной реакции у мономеров IgD и IgЕ участвуют два антигенсвязывающих участка (активных центра), обусловливающих бивалентность антител. При этом каждый активный центр связывается с одним из эпитопов поливалентного антигена, образуя сетевую структуру, которая выпадает в осадок. Наряду с бивалентными существуют моновалентные антитела, у которых функционирует лишь один из двух активных центров, способный связаться лишь с единичной антигенной детерминантой без последующего образования сетевой структуры иммунных комплексов. Такие антитела называются неполными, они выявляются в сыворотке крови с помощью реакции Кумбса.
1. IgG — преобладающий класс АТ, производится в больших количествах при иммунном (вторичном) ответе и защищает ткани от бактерий, вирусов и токсинов. Ig G усиливают фагоцитоз посредством опсонизации. Из всех Ig
только IgG способны проходить через плацентарный барьер.
Иммуноглобулины класса G (Ig G) составляют около 80% сывороточных иммуноглобулинов (в среднем 12 г/л), с молекулярной массой 160000 и скоростью седиментации 7S. Они образуются на высоте первичного иммунного ответа и при повторном введении антигена (вторичный ответ).
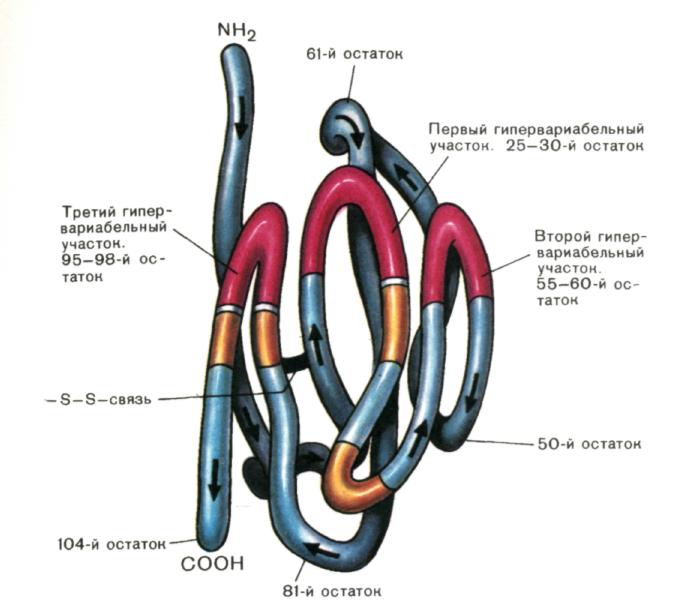
Рис. 3. Пространственная организация V-домена Н-цепи IgG1 человека (миеломного белка New).
Методами рентгеноструктурного анализа установлена пространственная организация V -домена. Упаковка в глобулу полипептида, составляющего V -домен, происходит так, что гипервариабельные участки оказываются в непосредственной близости друг от друга со стороны «внешнего» NН2-конца. Желтые сегменты — участки цепи, вступающие в контактное взаимодействие с VL-доменом при образовании антигенсвязывающей области активного центра.
Ig G обладают достаточно высокой авидностью, т. е. сравнительно высокой скоростью связывания с антигеном, особенно бактериальной природы. При связывании активных центров Ig G с эпитопами антигена в области его Fс-фрагмента обнажается участок, ответственный за фиксацию первой фракции системы комплемента, с последующей активацией системы комплемента по классическому пути. Этим обусловливается способность Ig G участвовать в защитных реакциях бактериолиза. Ig G является единственным классом антител, проникающим через плаценту в организм плода. Через некоторое время после рождения ребёнка содержание его в сыворотке крови падает и достигает минимальной концентрации к 3-4 мес., после чего начинает возрастать за счет накопления собственных Ig G, достигая нормы к 7 годам. Из всех классов Ig в организме больше всего синтезируется Ig G. Около 48% Ig G содержится в тканевой жидкости, в которую он диффундирует из крови. Ig G так же как Ig других классов, подвергается катаболическому распаду, который происходит в печени, макрофагах, воспалительном очаге под действием протеиназ.
2. IgM — пентамер, пять субъединиц соединены между собой дисульфидными связями. Единственная , J-цепь, связанная дисульфидными мостиками с тяжёлыми цепями, инициирует сборку пентамера. Ig М — первый класс АТ, продуцируемых развивающимися В-клетками при первичном попадании Аг в организм. Большая молекула Ig М легко акти-вирует комплемент и служит как опсонин при фагоцитозе. Многие АТ против грамотрицательных бактерий относятся к Ig М.
Иммуноглобулины класса М (Ig М) первыми начинают синтезироваться в организме плода и первыми появляются в сыворотке крови после иммуни-зации людей большинством антигенов. Они составляют около 13% сыворо-точных иммуноглобулинов при средней концентрации 1 г/л. По молеку-лярной массе они значительно превосходят все другие классы иммуно-глобулинов Это связано с тем, что Ig М являются пентамерами, т. е. состоят из 5 субъединиц, каждая из которых имеет молекулярную массу, близкую к Ig G. К Ig М принадлежит большая часть нормальных антител — изогемаг-глютининов, которые присутствуют в сыворотке крови в соответствии с принадлежностью людей к определенным группам крови. Эти аллоти-пические варианты Ig М играют важную роль при переливании крови. Они не проходят через плаценту и обладают наиболее высокой авидностью. При взаимодействии с антигенами in vitro вызывают их агглютинацию, преци-питацию или связывание комплемента. В последнем случае активация системы комплемента ведет к лизису корпускулярных антигенов.
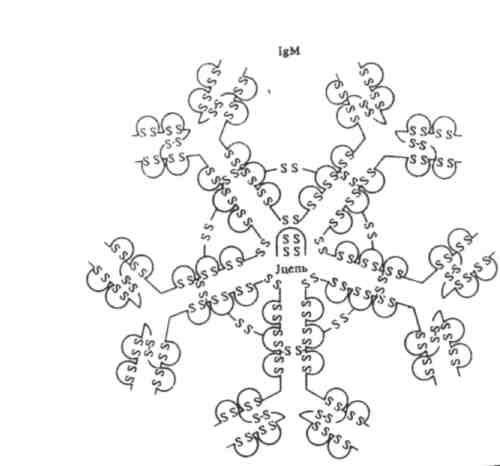
Рис. 4. Структура иммуноглобулина М пентамера.
3. Ig А — основной класс АТ в секретах (слюна, слёзы, молоко). Выделяется на поверхность слизистых оболочек, где и взаимодействует с Аг. Следовательно, Ig А участвует в защитной функции организма, укрепляя барьер в слизистой оболочке пищеварительного тракта, дыхательных, половых и мочевыделительных путей. Молекула Ig А в составе секрета — димер, содержащий одну, J-цепь и дополнительную полипептидную цепь, называемую секреторным компонентом. Этот компонент синтезирует эпителиальная клетка, на поверхность которой и выделяется димер. Вероятно, секреторный компонент участвует не только в связывании молекул Ig А и их внутриклеточном транспорте, но и в защите молекулы Ig А от переваривания протеолитическими ферментами секретов.
Иммуноглобулины класса А (Ig А) встречаются в сыворотке крови и в секре-тах на поверхности слизистых оболочек. В сыворотке крови присутствуют мономеры Ig А с константой седиментации 7S в концентрации 2,5 г/л. Данный уровень достигается к 10 годам жизни ребенка. Сывороточный Ig А синтезируется в плазматических клетках селезенки, лимфатических узлов и слизистых оболочек. Они не агглютинируют и не преципитируют антигены, не способны активировать комплемент по классическому пути, вследствие чего не лизируют антигены.
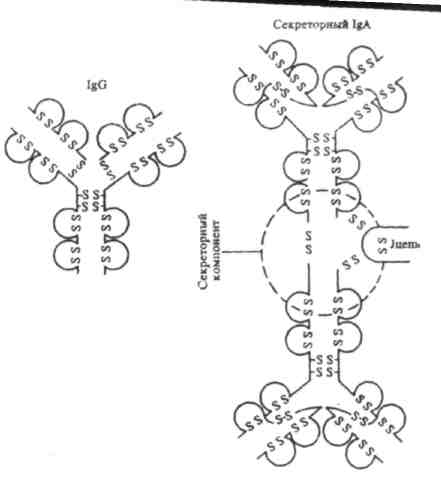
Рис.5. Структура иммуноглобулина Ig А (секреторного) - димера. Для сравнения — структура иммуноглобулина IgG.
Секреторные иммуноглобулины класса Ig А /S Ig À/отличаются от сыво-роточных наличием секреторного компонента, связанного с 2 или 3 моно-мерами иммуноглобулина А. Секреторный компонент является (β -глобу-лином с молекулярной массой 71000 D. Он синтезируется клетками секре-торного эпителия и может функционировать в качестве их рецептора, а к IgА присоединяется при прохождении последнего через эпителиальные клетки.
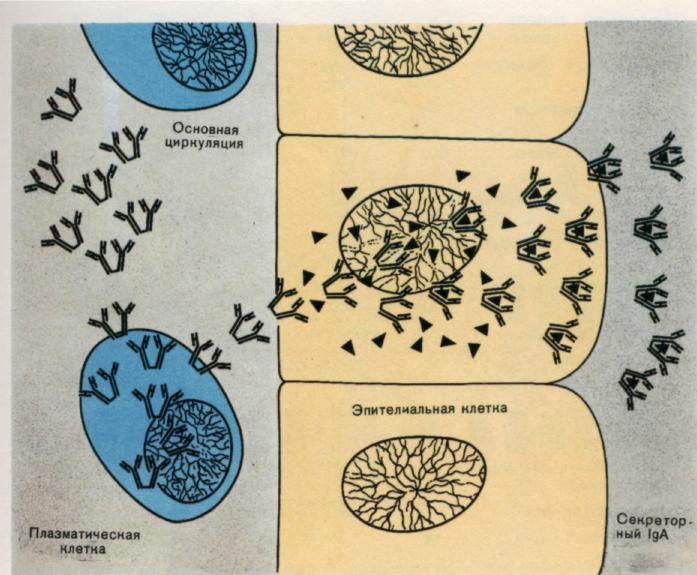
Рис. 6. Синтез и транспорт секреторного Ig А.
Ig А обычно циркулирует в мономерной (7S) или димерной (9S) форме; встречаются и более крупные объединения — три- и тетрамеры. Ig А.— основной представитель иммуноглобулинов в секретах организма (слюна, секрет кишечника, слезы, молозиво). Проникая в эпителиальные клетки, Ig А образует комплекс с «секреторным фактором», который, очевидно, защищает его от действия гидролитических ферментов и помогает выходу в субэпителиальное пространство. Хотя Ig А не связывает комплемент и в силу этого не обладает бактерицидной активностью, очевидно, он играет важную роль в нейтрализации бактериальных токсинов и локализации вирусов, препятствует их проникновению в организм.
Секреторные IgА играют существенную роль в местном иммунитете, пос-кольку препятствуют адгезии микроорганизмов на эпителиальных клетках слизистых оболочек рта, кишечника, респираторных и мочевыводящих путей. Вместе с тем SIgÀ в агрегированной форме активирует комплемент по альтернативному пути, что приводит к стимуляции местной фагоцитарной зашиты. Секреторные IgÀ препятствуют адсорбции и репродукции вирусов в эпителиальных клетках слизистой оболочки, например при аденовирусной инфекции, полиомиелите, кори. Около 40 % общего IgÀ содержится в крови.
4. Ig Е специфически взаимодействует с тучными клетками и базофильными лейкоцитами. Эти клетки содержат сосредоточенные в гранулах биологически активные амины. Выделение этих веществ из клетки (дегрануляция) вызывает резкое расширение просвета венул и увеличение проницаемости их стенок. Подобную картину можно наблюдать при аллергических реакциях. Иммуноглобулины класса Е (IgЕ). В норме содержатся в крови в концентрации 0.00025 г/л. Он синтезируется плазматическими клетками в бронхиальных и перитонеальных лимфатических узлах, в слизистой оболочке желудочно-кишечного тракта со скоростью 0.02 мг/кг массы в день. Иммуноглобулины класса Е называют также реагинами, поскольку они принимают участие в анафилактических реакциях, обладая выраженной цитофильностью.
5. Ig D. Его биологическая не установлена, присутствует в сывороткев крайне низких концентрациях, появляется на поверхности развивающихся В-лимфоцитов.
Иммуноглобулины класса D (IgD). До 75% IgD содержится в крови, достигая концентрации 0,03 г/л. Он имеет молекулярную массу 160 000 и скорость седиментации около 7S. IgD не проходит через плаценту и не связывает комплемент. До сих пор неясно, какие функции выполняет. Полагают, что он является одним из рецепторов предшественников В-лимфоцитов.
Дата добавления: 2017-01-16; просмотров: 2551;











