Произведение растворимости. Примеры решения задач
Гетерогенное равновесие "осадок ↔ насыщенный раствор" подчиняется правилу произведения растворимости. Если малорастворимый
электролит диссоциирует по уравнению AmBn 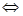 [А+]m - [B-]n. Отсюда вытекают два следствия:
[А+]m - [B-]n. Отсюда вытекают два следствия:
1. Условие растворения осадка. Произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости:[А+]m[B-]n<ПР (AmBn).
2. Условие осаждения осадка. Произведение концентраций ионов,
возведенных в степень их стехиометрических коэффициентов, должно
быть больше величины произведения растворимости: [А+]m[B-]n>Пр(AmBn).
Пример 1. Определение условий выпадения осадка. Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов хлористого кальция и углекислого натрия? (Пр(СаСО3) = 1,0∙10-3)
Решение: При смешении равных объемов растворов CaCI2 и Na2CO3объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно,
[CaCI2]= [Ca+2] = 0,02∙0,5=1∙10-2 моль∙л-1.
[Na2CO3] = [CО32-] = 0,2∙0,5 = 1∙10-2 моль∙л-1.
Откуда [Ca+2]∙[CО32-]= 1∙10-2 ∙1∙10-2 = 1∙10-4 . Осадок образуется, так как 1,0∙10-3< 1∙10-4
Пример 2. Вычисление концентрации ионов малорастворимого электролита в его насыщенном растворе.
Произведение растворимости BaF2 при 18 º С равно 1,7∙106. Рассчитайте концентрацию ионов Ba+2 и F- в насыщенном растворе BaF2 при этой температуре.
Решение: BaF2 диссоциирует по уравнению BaF2 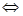 Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР (BaF2) = [Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР (BaF2) = [Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
ПР (BaF2) = [Ва+2] ∙ 2∙ [Ва+2]2 = 4[Ва+2]3= 1,7∙10-6
Концентрация ионов [Ва+2] равна: [Ва+2]= √1,7∙10-6 / 4 = 0,75∙10-2 моль∙л-1;
Концентрация ионов F-1 равна: [F-1]=0,75∙10-2∙2=1,5∙10-2 моль∙л-1;
Пример 3. Вычисление произведения растворимости малорастворимого электролита.
Растворимость Ag3PO4в воде при 20 º С равна 0,0065 г∙л-1. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 в моль∙л-1 равна:
Р=6,5∙10-3/418,58 = 1,6∙10-5 моль∙л-1.
При диссоциации 1 моль Ag3PO4образует 3 моль ионовAg+. 1 моль ионов PO43-, поэтому концентрация ионов PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
С[PO43-] =1,6∙10-5моль∙л-1. [Ag+]= 3∙1,6∙10-5. Произведение растворимости Ag3PO4равно:
ПР=[Ag+]3 + [PO43-]= (4,8∙10-5)3∙1,6∙10-5= 110,6 ∙10-15∙1,6∙10-3= 1,77∙10-18.
Пример 4. Определение условий одновременного выпадения осадков солей из раствора.
При каком соотношении концентрации ионов Zn+2Cd+2 в растворе прибавление к нему раствора Na2CO3вызывает одновременное осаждение карбонатов этих ионов? ПР(ZnCOз)= 6∙10-11
Решение. Концентрацию вводимых карбонат-ионов обозначим через
[СО32- ], тогда
[Zn+2]=ПР(ZnCOз) / С(СО32-), [Cd+2] = ПР (CdСОз)/[СО32- ].
[Zn+2]/[Cd+2] = ПР(ZnCOз)/ПР (CdСОз)=6∙10-11/2,5∙10-14=2,4∙103=2400
Карбонаты цинка и кадмия будут выпадать одновременно из раствора, если [Zn+2] >[Cd+2] в 2400 раз. Если отношение [Zn+2] /[Cd+2] > 2400, то первым из раствора будет выпадать ZnCOз до тех пор, пока отношение [Zn+2] /[Cd+2] не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [Zn+2] /[Cd+2] не достигнет значения, при котором ZnCOз и CdСОз будут осаждаться одновременно.
Пример 5. Вычисление растворимости электролита по величине
произведения растворимости.
Произведение растворимости ПР оксалата бария ВаС2О4 равно
1,62∙10-1. Вычислите растворимость ВаС2О4 в воде.
Решение. В растворе труднорастворимого сильного электролита
ВаС2О4 существует равновесие: ВаС2О4= Ва+2 + (С2О42-).
ПрВаС2О4= [Ва+2] ∙ [С2О42-]
в осадке в растворе
Так как оксалат бария диссоциирует на два иона, то концентрация его в растворе равна концентрации каждого из ионов, т.е.
[ВаС2О4] = [Ва+2] = [С2О42-] = √1,62∙10-7 = 0,4∙10-3моль-л-1.
т.е. растворимость оксалата бария в воде при t =20°С равна 0,4∙10-3моль-л-1.
ЖЕСТКОСТЬ ВОДЫ
В природной воде содержатся различные по растворимости соли.
Если в воде содержится большое количество солей кальция или магния, то такая вода называется жесткой в отличие от мягкой воды,
в которой таких солей мало или они отсутствуют. Суммарное содержание в воде солей кальция и магния называется общей жесткостью.
Она подразделяется на карбонатную и некарбонатную.
Карбонатная жесткость обусловлена содержанием гидрокарбонатов
кальция и магния; некарбонатная - содержанием сульфатов или хлоридов кальция и магния.
Вода, обладающая карбонатной жесткостью, при кипячении дает
осадок, состоящий в основном из карбоната кальция СаСО3
Са(НСС3)2 → СаСО3↓ + СО2↑ + Н2О
Карбонатная жесткость относится к временной жесткости, количественно она характеризуется содержанием гидрокарбонатов, удаляющихся при кипячении воды в течение одного часа. Жесткость, остающаяся посте такого кипячения, называется постоянной жесткостью.
Сумма миллиэквивалентов ионов магния и кальция, содержащаяся
в 1 литре воды, определяет ее жесткость. Один миллиэквивалент жесткости соответствует содержанию 20,04 мг/л [Са2+] или 12,16 мг/л [Mg2+].Жесткость природной воды в разных водоемах различна и колеблется в течение года. Из Европейских рек наибольшую жесткость воды имеет Волга (общая - 5,9; карбонатная - 3,5 ткь/я), наименьшую - Нева (общая0,5; карбонатная - 0,5 мэкв/л). Жест кость Москвы-реки - общая - 4,2, карбонатная 4,1 мэкв/л.
Жесткая вода непригодна для технических целей, Для уменьшения
жесткости используют методы водоумягчения:
- осаждение катионов Са2+ и Mg2+кипячением или добавлением
химических реагентов ( Na2CO3) ;
- ионный обмен (воду пропускают последовательно через слой
катионита и слой анионита).
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее со-
держится 202,5 г Са(НСОз)2.
Решение. В 1л воды содержится 202,5 : 500 = 0,405 г Са(НСОз)2 ,
что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л.
81 г/моль - эквивалентная масса Са(НСОз)2. Следовательно, жесткость воды 5 мкэв.
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если
жесткость, обусловленная присутствием этой соли, равна 4 мэкв?
Решение: Мольная масса CaSO4=136,14 г/моль; эквивалентная
масса равна 136,14/2=63,07 г/моль. В в 1 м3 воды жесткостью 4 мэкв содержится 4∙1000=4000 мэкв, или 4000∙68,07= 272280 мг= 272,280 г CaSO4 .
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы
устранить ее жесткость равную 5 мквэ?
Решение. В 500 л вода содержится 530 ∙ 5 = 2500 мквэ солей, обусловливающих жесткость воды. Для устранения жесткости следует
прибавить 2500 ∙ 53 = 132 500 мг = 132,5 г соды (53 г/моль - эквивалентная масса Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что натитрование 100 см3 этой воды, содержащей гидрокарбонат кальция,
потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорцию.
6,25/100=х/0,08, х= 0,005.
Таким образом, в 1 л исследуемой воды содержится 0,005∙1000 = 5 мэкв гидрокарбоната кальция или 5 мэквСа2+ ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, применяя формулу Ж =m/ЭV, где m- масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э - эквивалентная масса этого вещества; V - объем воды, л.
Решение примера 1. Ж =m/ЭV=202500/81∙500=5 мэкв. 81 - эквивалентная масса Ca(HCO3)2, равная половине его мольной массы.
Решение примера 2. Из формулыЖ =m/ЭV, m = 4∙68,07∙1000=272280 мг = 272,280 г. CaSO4.
Дата добавления: 2019-09-30; просмотров: 842;











