Характеристические функции (Термодинамические потенциалы)
По прежнему рассматриваем простейшую систему с одним внешним параметром. Основное уравнение:
TdS = dU + pdV (1)
Здесь, однако, 5 переменных. Само же состояние системы описывается двумя, например, Т и V, а остальные 3 функции неизвестны. Для их определения надо добавить еще уравнение состояния p = p(V, T) (2) и зависимость U = U(V,T) (3) (для идеального газа – закон Джоуля U = CVT). Однако, если правильно выбрать независимые переменные вместо двух дополнительных уравнений можно обойтись и одним. Например, пусть знаем U = U(S, V), Перепишем (1) как
dU = TdS – pdV (4)
Выберем S и V как независимые переменные. U – полный дифференциал.
Тогда
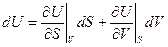 , т.е.
, т.е. 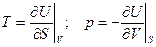 (5)
(5)
Эти формулы аналогичны по структуре формулам, связывающим в механике силу и потенциальную энергию. Поэтому внутренняя энергия U называется термодинамическим потенциалом (характеристическая функция в переменных U и V). Метод термодинамических потенциалов (мы увидим, что не один) был развит Гиббсом во второй половин 19 века. Из равенства смешанных производных следует:
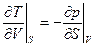 (6)
(6)
Это соотношение взаимности (первое) Максвелла, связывающее два свойства системы: изменение температуры при адиабатическом расширении и изменение давление при изохорном сообщении теплоты системе. Установление таких связей и составляет метод термодинамических потенциалов.
Еще: 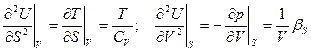 Можно найти CV и βS
Можно найти CV и βS
Возьмем другие переменные: T и V. Перепишем (1) в виде:
TdS + SdT – SdT = dU + pdV, или d(U-ST) = -pdV – SdT (7)
Здесь F = U – TS (8) – свободная энергия термодинамическая функция в переменных V и T:
dF = -pdV – SdT (7`)
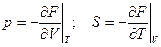 (9)
(9)
Соотношение взаимности здесь: 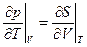 (10)
(10)
(еще называют функцией Гельмгольца)
Почему свободная энергия? Из (7`) следует, что при изотермических процессах работа совершается только за счет убыли F, а не U (как при адиабатических процессах), т.е.F характеризует возможность системы совершать работу. Величина TS называется связной энергией. В ТД внутренняя энергия складывается из свободной и связной: U = F + TS (в механике кинетической и потенциальной)
Еще: 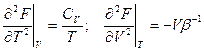
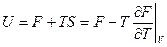 (11) – 1-е уравнение Гиббса-Гельмгольца, связывающее U и F
(11) – 1-е уравнение Гиббса-Гельмгольца, связывающее U и F
Возьмем независимые переменные p и T.
(7`): dF = -SdT – pdV +Vdp – pdV = -SdT + Vdp – d(pV) => dФ = d(F + pV) = -SdT +Vdp (12)
Ф = F + pV = U – TS + pV (12`) – энергия Гиббса (термодинамический потенциал Гиббса)
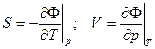 (13)
(13)
Соотношение взаимности Максвелла
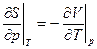 (14)
(14)
Используя Ф, удобно получить выражение для Сp (вторая производная t):
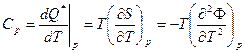 (15)
(15)
Другая вторая производная дает коэффициент сжимаемости:

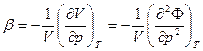 (16)
(16)
Физический смысл: при изотермическом процессе (dT = 0) убыль энергии Гиббса
(-Vdp) равна работе расширения системы (газ + поршень с грузом) при адиабатических процессах!!!
Энергия такой системы равна:
E = U + pSh
dE = dU + pdV +Vdp; и при dS = 0:
-dE = -Vdp (убыль энергии равна работе) Другой смысл Ф – убыль Ф = работе немеханических сил, но это в более сложных системах, можно показать.
Еще про Ф: (12`)
U = Ф + TS – pV. С учетом (13):
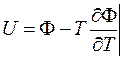 U = Ф -
U = Ф -
Наконец возьмем независимые переменные S и P
Тогда (вперед!)
dU = TdS – pdV ± Vdp = TdS +Vdp – d(pV)
dI = d(U + pV) = TdS + Vdp (18)
I = U + pV – теплосодержащая функция или энтальпия.
При p = const => đQ* = dI, кроме того I = E – энергии расширенной системы
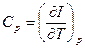 (19)
(19)
из (18)
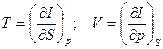 (19`)
(19`)
Соотношение взаимности:
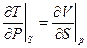 (20)
(20)
устанавливает связь между термодинамическими потенциалами и позволяет решить ряд практических задач. НО!!! Сами потенциалы должны быть определены из опыта (например, идеальный газ U = CVT) или вычислен с помощью статфизики. Статфизикой займемся уже на следующей лекции. А пока соотношение взаимности получили в простой системе с одним внешним параметром V. Что в более сложных системах?
Основное уравнение:
(21) 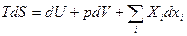 , где xi – внешние параметры (остальные)
, где xi – внешние параметры (остальные)
Отсюда: 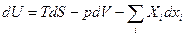 ; и если за независимые переменные взять набор {S, V, xi}, то характеристическая функция – внутренняя энергия.
; и если за независимые переменные взять набор {S, V, xi}, то характеристическая функция – внутренняя энергия.
Если {T, V, xi}, то характеристическая функция – свободная энергия.
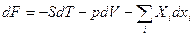 (22)
(22)
Если {T, p, Xi} (обобщенные силы взяты за независимые переменные), то характеристическая функция – потенциал Гиббса 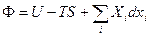 (23)
(23)
И наконец {T, S, Xi}, то – энтальпия I = U + pV +Xixi, и:
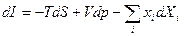 (24)
(24)
Однако, можно выбрать, например, {T, p, Xi} или {T, S, xi}, тогда выражения для Ф и I останутся как раньше: Ф = U - TS + pV, I = U pV, а в (21) и (22) 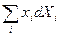 заменить на
заменить на 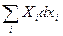
Можно вводить и новые характеристические функции добавляя в (22, например) 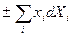 , тогда
, тогда 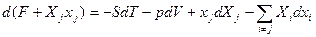 , и F+Xjxj. – новая характеристическая функция. Все это – основы термодинамического аппарата.
, и F+Xjxj. – новая характеристическая функция. Все это – основы термодинамического аппарата.
Пример применения: Газ Ван-дер-Ваальса. 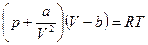 (1), здесь a и b – константы Ван-дер-Ваальса:
(1), здесь a и b – константы Ван-дер-Ваальса:
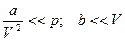 . b – объем молекул, а
. b – объем молекул, а 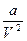 - внутренняя энергия газа, определяемая взаимным притяжением молекул газа. Из (1):
- внутренняя энергия газа, определяемая взаимным притяжением молекул газа. Из (1): 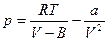 . Подставляем в 1-е следствие основного уравнения:
. Подставляем в 1-е следствие основного уравнения:
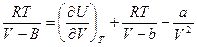 и
и 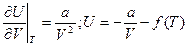 Отсюда, при Và∞ U = f(T), но при Và∞ переход к идеальному газу, где U = CVT. Следовательно f(T) = 0 и U = CVT – a/V
Отсюда, при Và∞ U = f(T), но при Và∞ переход к идеальному газу, где U = CVT. Следовательно f(T) = 0 и U = CVT – a/V
Дата добавления: 2021-05-28; просмотров: 528;











