Кинетика сложных реакций
При изучении кинетики сложных реакций используют принцип независимого протекания процесса: если в системе одновременно протекают несколько простых реакций, то скорость каждой из них пропорциональна концентрациям только тех веществ, которые участвуют в данной реакции.
Иначе говоря, каждая стадия сложной реакции подчиняется основному постулату формальной кинетики (уравнения 4 и 5) независимо от других стадий с учетом направления процесса
Основные типы сложных реакций рассмотрим на примере реакций первого порядка.
1) Обратимые реакции – реакции, протекающие одновременно в двух противоположных направлениях:
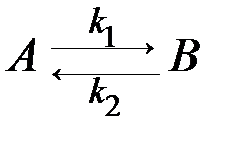 .
.
Кинетическое уравнение записывается следующим образом:
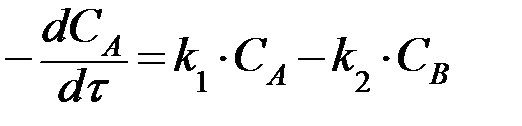
 (22)
(22)
и с учетом обозначений, введенных в пункте 1.2, принимает вид:
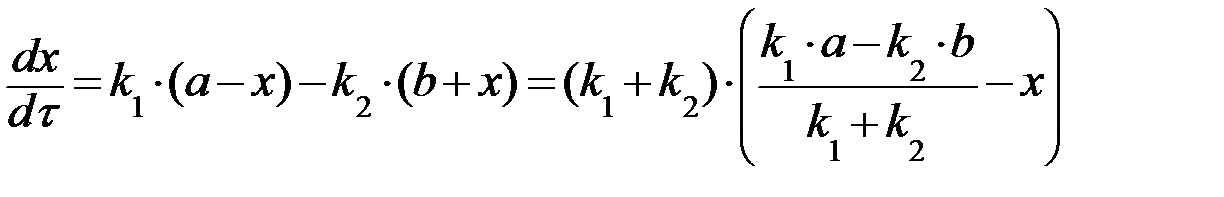 , (23)
, (23)
или 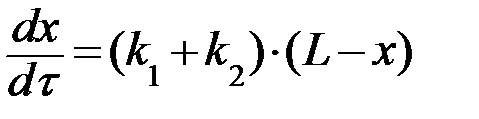 , (24)
, (24)
где постоянная L отвечает равновесному состоянию системы и может быть рассчитана через константы скорости прямой и обратной реакций k1 и k2 или через константу равновесия 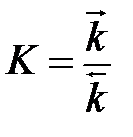 по следующему уравнению:
по следующему уравнению:
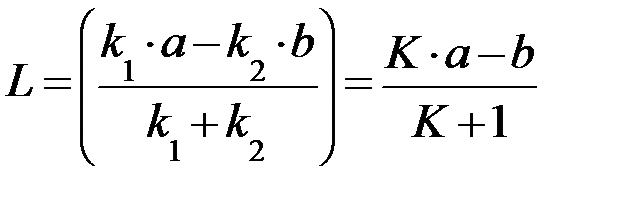 . (25)
. (25)
В свою очередь константа равновесия обратимой реакции может быть вычислена из уравнения изотермы химической реакции с использованием стандартных термодинамических таблиц.
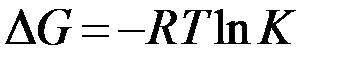 .
.
Решение уравнения (24) позволяет рассчитать сумму констант скорости прямой и обратной реакции:
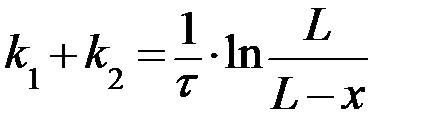 . (26)
. (26)
2) Параллельные реакции – реакции, в которых исходное вещество реагирует сразу по нескольким направлениям:
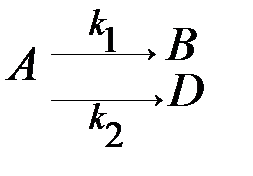 .
.
Кинетическое уравнение записывается с учетом принципа независимости:
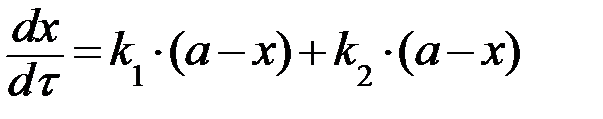 , (27)
, (27)
а решение этого уравнения сходно с интегральными уравнениями для необратимой реакции первого порядка
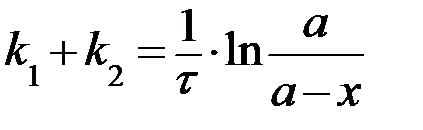 , (28)
, (28)
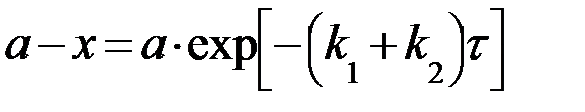 . (29)
. (29)
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
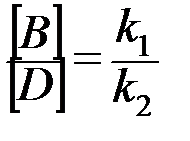 . (30)
. (30)
3) Последовательные реакции – реакции, протекающие через образование неустойчивых промежуточных веществ:
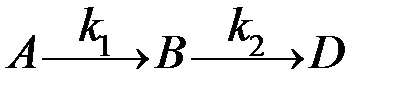 .
.
Применим к такой системе закон действующих масс и принцип независимого протекания процесса, если в начальный момент времени в реакционном объеме есть только реагент А:
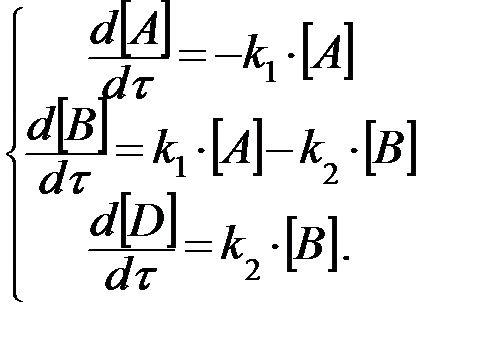 (31)
(31)
Решение системы уравнений (31) позволяет рассчитать концентрации всех веществ как функции времени аналитически
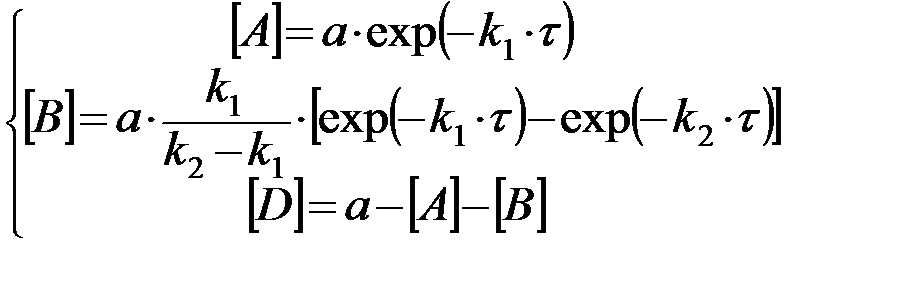 (32)
(32)
и интерпретировать полученные зависимости графически (рис. 11).
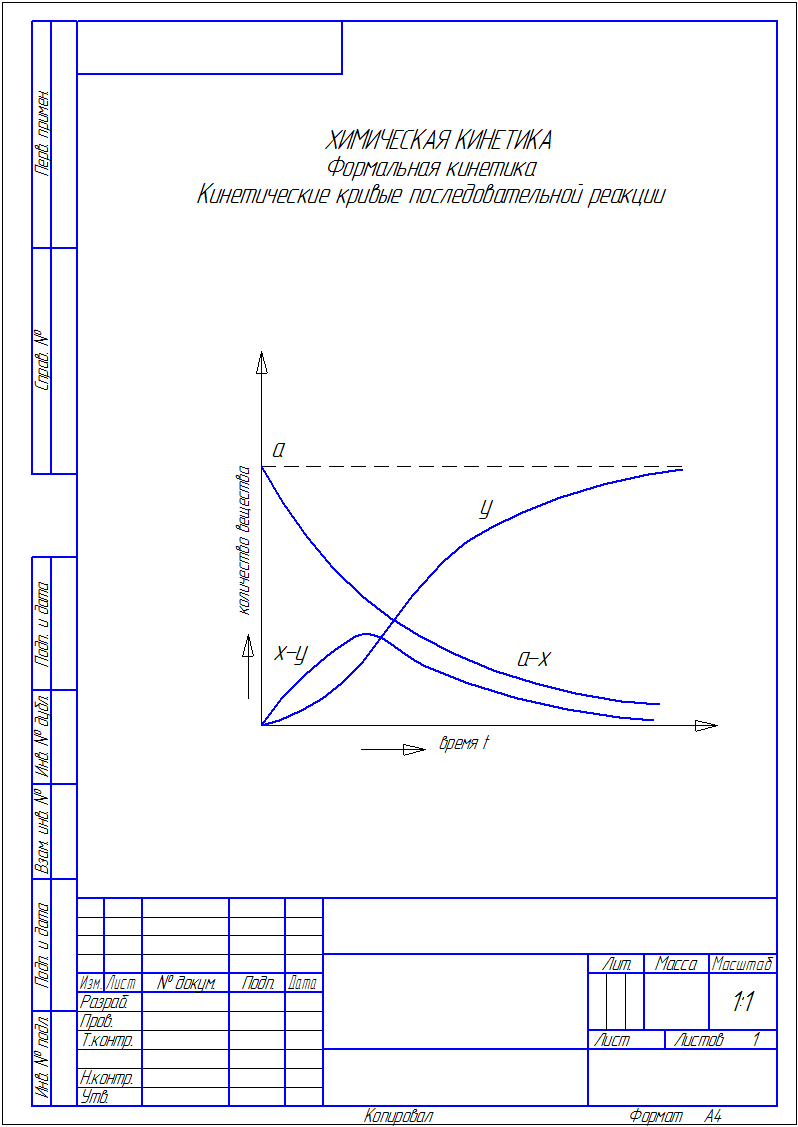
Рис. 8 Зависимость концентраций веществ от времени в системе двух последовательных реакций первого порядка, где (а-х) – СА, (х-у) – СВ, у - СD.
Концентрация исходного вещества А уменьшается по экспоненте. Концентрация промежуточного вещества В достигает максимума в точке
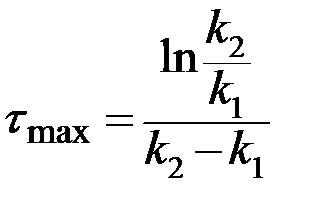 , (33)
, (33)
и величина этого максимума определяется отношением констант k1/k2.
Если оно мало (k1>>k2), то промежуточный продукт быстро накапливается и медленно расходуется, его максимальная концентрация почти достигает исходной концентрации реагента А. Если же оно мало (k1<<k2), то промежуточный продукт не успевает накапливаться, и его концентрация в любой момент времени близка к нулю. В этом случае для анализа кинетических уравнений можно использовать принцип стационарного протекания процесса,согласно которому скорость образования промежуточного вещества в любой момент времени равна скорости его расходования.
Кинетическая кривая для продукта D имеет S-образную форму с точкой перегиба. Как нетрудно показать из системы уравнений (31), время достижения точки перегиба равно τmax, то есть совпадает со временем достижения максимальной концентрации промежуточного продукта В. До точки перегиба продукт D быстрее образуется, чем расходуется, а после неё скорость его образования постоянно уменьшается. При малых временах концентрация D настолько мала, что его нельзя обнаружить в системе – индукционный период.
Если промежуточный продукт В неустойчив (k1<k2), то слагаемым 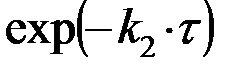 в с кинетическом уравнении (32) для [В] можно пренебречь, тогда
в с кинетическом уравнении (32) для [В] можно пренебречь, тогда
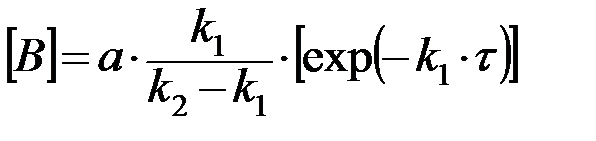 , (34)
, (34)
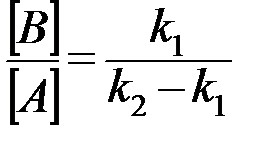 , (35)
, (35)
то есть отношение концентраций промежуточного продукта и реагента становится постоянным – переходный период.
Если лимитирует первая стадия (k1<<k2), то в уравнении (35) можно пренебречь величиной k1 в знаменателе, что приводит к выражению:
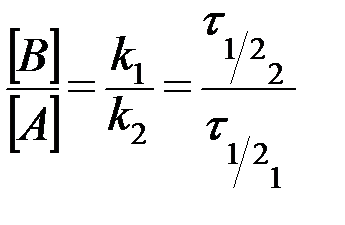 . (36)
. (36)
Это означает, что отношение концентраций промежуточного и исходного веществ равно отношению их периодов полураспада. Такое состояние называют вековым равновесием. Оно устанавливается при временах мого больших периода полураспада промежуточного соединения.
Дата добавления: 2021-04-21; просмотров: 338;










