Кинетика реакций целого порядка
Химическая кинетика. Основные понятия и постулаты формальной кинетики
Химическая кинетика- раздел физической химии, изучающий скорости химических реакций. Задачами химической кинетики являются: 1) расчет скоростей реакций и построение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции определяется изменением числа молей (n) вещества в единицу времени в единице объема. Скорость в момент времени τ (истинная скорость):
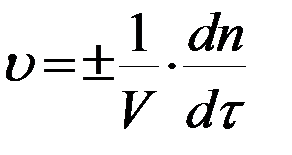 . (1)
. (1)
Знак плюс используют, если определяют скорость по продукту, а минус – по исходному веществу. Для реакций, протекающих при постоянном объеме, скорость выражают через молярную концентрацию 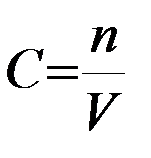 :
:
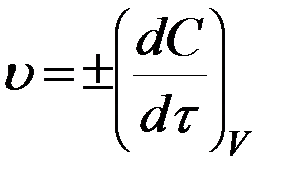 (2)
(2)
Среднюю скорость за время ∆τ определяют через конечные разности:
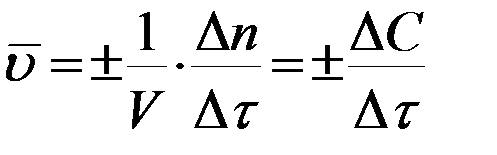 . (3)
. (3)
Если в реакции участвуют несколько реагентов, то скорость можно выражать через концентрацию любого из них, так как концентрации веществ связаны стехиометрическими соотношениями.
Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления реагентов.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации веществ является предметом изучения формальной кинетикии описывается основным её постулатом – законом действующих масс: скорость химической реакции 
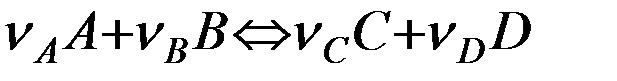 в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведенным в некоторые степени
в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведенным в некоторые степени
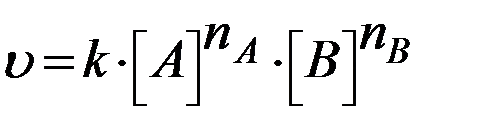 ,(4)
,(4)
где k – константа скорости реакции, nA и nB – некоторые числа, которые называют частным порядком реакции по веществам А и В соответственно. Эти числа в общем случае не равны стехиометрическим коэффициентам νА и νВ в уравнении реакции. Сумму показателей степеней в кинетическом уравнении (4) 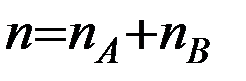 называют общим порядком реакции.
называют общим порядком реакции.
Порядки реакций – эмпирические величины и не отражают механизма реакции. Они могут быть положительными или отрицательными, целыми или дробными и устанавливаются только экспериментальными методами. Размерность константы скорости также определяется порядком реакции.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными химическими реакциями (элементарными актами). Под элементарной химической реакцией понимают единичное столкновение и взаимодействие частиц реагентов, сопровождающееся разрывом или образованием химических связей и приводящее к возникновению новых частиц продуктов реакции или промежуточных соединений.
Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. По молекулярности различают элементарные реакции только трех типов.
Мономолекулярные реакции – элементарные реакции, в которых участвует только одна частица (реакции распада или изомеризации):
А → продукты
В бимолекулярных реакциях происходит столкновение и взаимодействие двух частиц одинаковой или разной природы:
2А → продукты,
А + В → продукты.
В тримолекулярных реакциях взаимодействуют одновременно три частицы:
А + В + С → продукты,
А + 2В → продукты,
3А → продукты.
Молекулярность реакции - всегда целое число. Реакции с молекулярностью больше трех в природе не встречаются, поскольку согласно кинетической теории газов вероятность одновременного столкновения более чем трех частиц стремится к нулю. Обычно такие реакции являются сложными и состоят из нескольких элементарных стадий. Совокупность элементарных реакций называют механизмом сложной реакции.
Таким образом, классифицировать по молекулярности можно только элементарные (или простые) реакции, протекающие в одну стадию в соответствии с химическим уравнением реакции.
Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны стехиометрическим коэффициентам в уравнении реакции. Порядок сложной реакции по веществу в общем случае никак не связан со стехиометрическими коэффициентами νА и νВ в уравнении реакции.
Можно назвать три основных причины несовпадения молекулярности и порядка реакции. Первая причина заключается в сложном механизме реакции. Скорость и порядок сложной реакции, протекающей в несколько стадий, определяются скоростью и порядком самой медленной стадии (принцип лимитирующей стадии).
Второй причиной несовпадения молекулярности и порядка реакции является избыточное содержание одного из исходных веществ. Концентрация этого вещества в ходе реакции практически постоянна, и скорость реакции будет зависеть от концентрации только того реагента, который взят в недостатке.
Например, реакция гидролиза сахарозы
C12H22O11 + H2Oизб → C6H12O6 глюкоза + C6H12O6 фруктоза ,
протекающая в большом избытке растворителя, бимолекулярна по уравнению реакции, но имеет первый порядок, так как ее скорость зависит только от концентрации сахарозы. Такие реакции называют псевдомономолекулярными.
Ассоциация (полимеризация) или диссоциация молекул участвующих в реакции веществ также приводит к различиям между молекулярностью и порядком реакции и является третьей причиной.
Кинетика реакций целого порядка
Кинетические уравнения реакций целого порядка, протекающих в закрытых системах при постоянном объеме, можно получить сочетанием уравнений (2) и (4). Очевидно, что скорости прямой и обратной реакций будут выражаться следующими уравнениями:
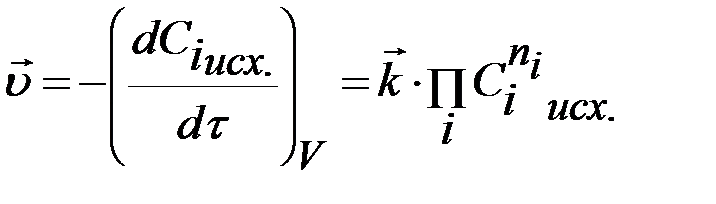 ,(5)
,(5)
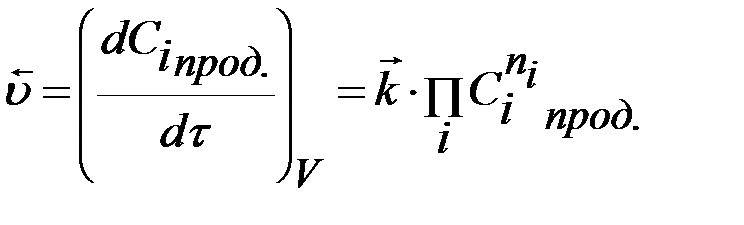 .(6)
.(6)
В простейшем случае для необратимой реакции n - го порядка
А + В + С → продукты
скорость реакции выражают через концентрацию одного из исходных веществ, например, вещества А:
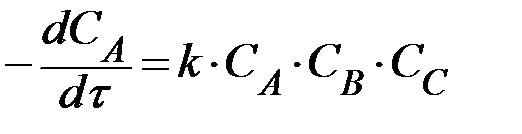 , (7)
, (7)
где СА, СВ, СС – текущие концентрации реагентов.
При записи кинетических уравнений обычно используют следующие обозначения: 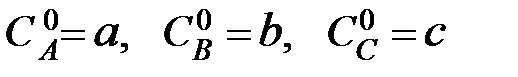 - начальные концентрации веществ А, В и С соответственно; х – количество вещества А, прореагировавшее к данному моменту времени τ;
- начальные концентрации веществ А, В и С соответственно; х – количество вещества А, прореагировавшее к данному моменту времени τ; 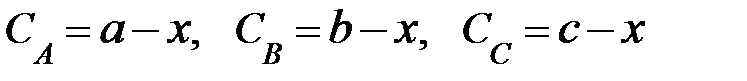 - текущие концентрации веществ А, В и С (в общем случае Сτ);
- текущие концентрации веществ А, В и С (в общем случае Сτ); 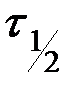 - период полураспада, т.е. время, в течение которого прореагирует половина исходного вещества
- период полураспада, т.е. время, в течение которого прореагирует половина исходного вещества 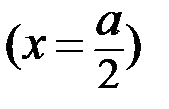 .
.
В этих обозначениях кинетическое уравнение (7) имеет вид:
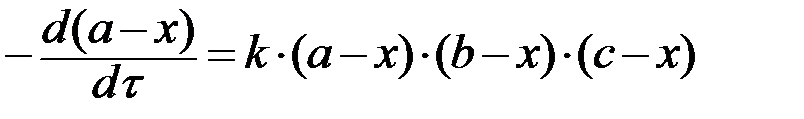 , (8)
, (8)
а при условии, что 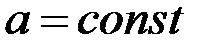 и
и 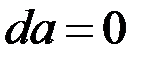 уравнение (8) можно записать:
уравнение (8) можно записать:
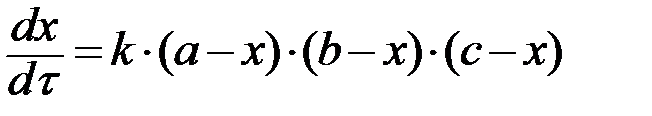 . (9)
. (9)
Решение уравнения (9) относительно константы скорости реакции получают его интегрированием, а значение постоянной интегрирования находят в граничных условиях: х = 0 и τ = 0 (момент начала реакции).
С учетом введенных обозначений кинетические уравнения необратимых реакций нулевого, первого, второго, третьего и n – го порядка и их решения имеют вид, представленный в таблице 1.
Таблица 1
| Порядок реакции n | Кинетическое уравнение реакции в дифференциальной и интегральной форме | Текущие концентрации веществ | Период полураспада |
| n=0 | 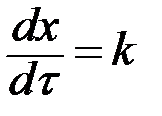 , , 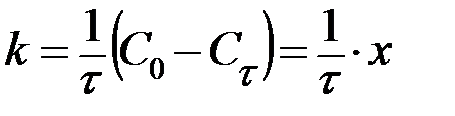
| 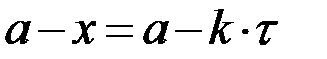
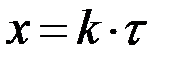
| 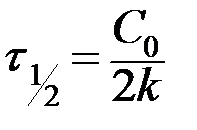
|
| n=1 | 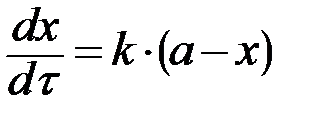 , , 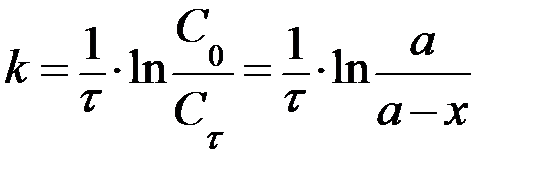
| 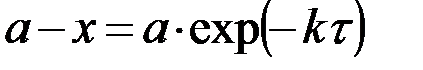
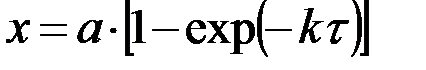
| 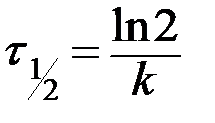
|
| n=2 | при a = b:
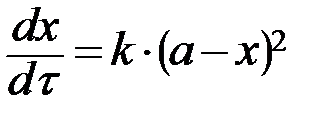 , , 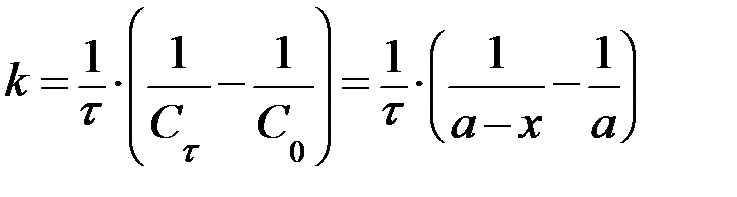 при a ≠ b:
при a ≠ b:
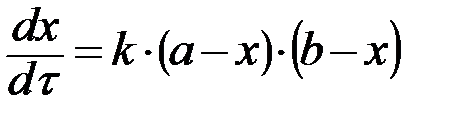 , , 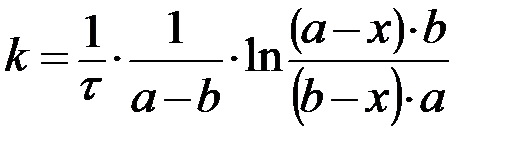
| 
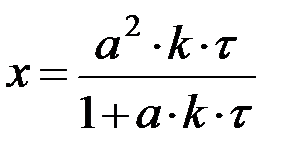
|
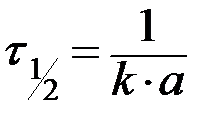
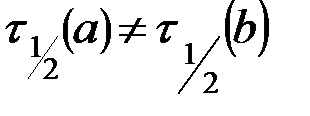
|
| n=3 | при a = b = с:
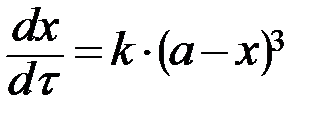 , , 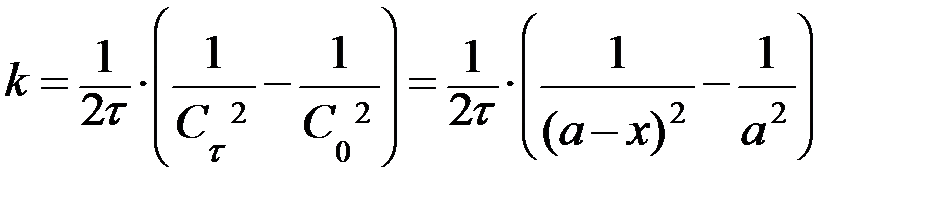
| 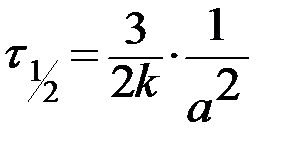
| |
| n –ый n A → продукты | 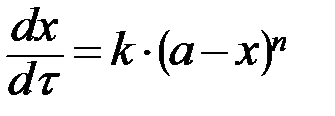 , , 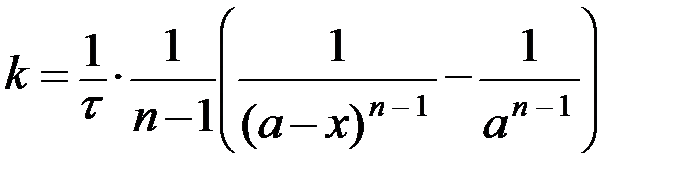
| 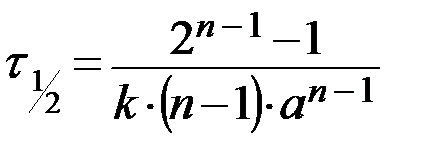
|
Дата добавления: 2021-04-21; просмотров: 575;










