Межмолекулярные взаимодействия. Комплексные соединения.
Силы Ван дер Ваальса. Водородная связь. Комплексные соединения. Строение комплексных соединений. Характер связи в комплексных соединениях с позиции метода валентных связей. Понятие о теории кристаллического поля и теории поля лигандов. Диссоциация комплексных соединений в растворе. Константа нестойкости.
Свойства веществ зависят не только от внутримолекулярного строения, но и от различных межмолекулярных взаимодействий.
Силы межмолекулярного взаимодействия называются силами Ван дер Ваальса (1900) – по имени датского ученого, впервые изучившего количественную характеристику этих сил.
Межмолекулярное взаимодействие имеет электрическую природу и отличается от химического тем, что оно проявляется на значительно больших расстояниях (0,4-0,7 НМ) и характеризуется небольшими энергиями связи (8–50 кДж/моль).
Молекула соединения в целом нейтральна, однако представляет собой совокупность положительных и отрицательно заряженных частиц.
Графическое изображение различных молекул:

При сближении молекул между ними возникает электростатическое взаимодействие трех видов:
1) ориентационное – полярная молекула (А) взаимодействует с полярной (В)
2) индукционное – полярная молекула (А) взаимодействует с неполярной молекулой (В) и индуцирует в ней небольшой дипольный момент
3) дисперсионное – неполярная молекула (А) взаимодействует с неполярной (В). Дисперсия (рассеяние) электрона создает синхронное появление и исчезновение мгновенных диполей молекул А и В, что и приводит к их притяжению:
Общая энергия взаимодействия определяется суммой энергией ориентационного индукционного и дисперсионного взаимодействий:
Еобщ = Ео + Еи + Ед.
Межмолекулярное взаимодействие осуществляется любыми молекулами различного агрегатного состояния. В газах оно минимально, в твердых веществах – максимально, в жидком состоянии занимает промежуточное положение между газообразным и твердым.
5.1. Водородная связь
Впервые образование водородной связи было обнаружено в 80-годах XIX века русскими учеными М. Ильинским и Н. Бекетовым.
Н-связь – это связь двух сильно электроотрицательных атомов посредством атома водорода. Общую схему образования такой связи можно представить так:
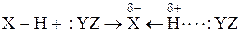 ,
,
X = Y = F, O, N, реже Cl, Br, C.
Атом водорода, связанный с сильно электроотрицательным атомом Х поляризован положительно. Поэтому он взаимодействует с другим сильно электроотрицательным атомом Y, обязательно имеющим неподеленную электронную пару. Энергия H-связи составляет 8-50 кДж/моль. Она может возникнуть между однородными и разнородными молекулами, а также внутри одной молекулы. Примеры:
1) H2O, 
2) Раствор соляной кислоты
3) Спирты, карбоновые кислоты
4) Салициловая кислота
5) Белки
Природа Н-связи даже в настоящее время не вполне ясна. Она, в основном имеет электростатический характер. Главную роль в ее образовании играют следующие факторы:
1) поляризация связи атома Н превращает его в частицу (протон) с уникальными свойствами – отсутствие собственной электронной оболочки, наличие самого малого радиуса, способность протона внедряться в электронное поле других атомов.
2) донорно-акцепторное взаимодействие. Акцептор-протон одной молекулы, донор электроотрицательный атом другой молекулы.
Н-связи проявляется почти повсеместно: в молекулах белков, нуклеиновых кислот, а также в процессах смачивания (пищи слюной), набухания, адсорбции. С помощью Н-связи определяются специфичность действия лекарств, вкусовые качества, сокращения мышц, функции памяти.
Н-связь сильно влияет на физико-химические свойства газообразных водородных соединений и объясняет многие их аномальные свойства (например воды).
5.2. Комплексные соединения (КС)
КС – это соединения, образующие сложные ионы, способные существовать в растворе и кристалле. К ним относится обширный класс неорганических и металлоорганических соединений:
5.3. Строение КС
Строение и свойства КС объясняет координационная теория, предложенная швейцарским химиком А. Вернером (1893). Впоследствии теория была дополнена русским ученым Л. Чугаевым.
Рассмотрим строение  с позиции современной координационной теории.
с позиции современной координационной теории.
1. Центральное место в КС занимает комплексообразователь – обычно это катион металла. В нашем примере – Fe2+.
2. Вокруг комплексообразователя скоординированы лиганды (партнеры), т.е. анионы или нейтральные молекулы. Их количество определяет координационное число (КЧ). В нашем примере лигандами являются цианид-анионы СN–, КЧ = 6.
3. Комплексообразователь и лиганды образуют внутреннюю сферу комплекса – сложный комплексный ион. В нашем случае  , он всегда записывается в квадратных скобках.
, он всегда записывается в квадратных скобках.
4. Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплекса. У нас – четыре иона К+.
5. Сплошная линия в графическом изображении комплекса означает химическую связь, возникшую по обменному механизму (механизму спаривания), а пунктирная линия – связь, образованную по донорно-акцепторному механизму.
6. Причина образования комплекса – стремление атомов к насыщаемости (максимальной валентности).
5.4. Характер связи в КС с позиции МВС
Комплексообразующая способность определяется тремя факторами: радиусом, зарядом и электронной конфигурацией атома-комплексообразователя.
Из четырех семейств S-, p-, d- и f-элементов лучшими комплексообразователями являются d-элементы, так как они имеют малый радиус, большой заряд и удобную электронную конфигурацию, которая позволяет образовывать связи по обменному и донорно-акцепторному механизму.
С позиции МВС образование КС происходит за счет обменного и донорно-акцепторного механизма. Обменный механизм проявляется в связи комплексообразователя и внешней сферы или с частицами лигандов. Донорно-акцепторный механизм чаще всего осуществляется за счет неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя. Например, в соединении  :
:
[Cu+2 −− − − − ] +2 SO4-2
5.5. Понятие о теории кристаллического поля и теории поля лигандов
В теории кристаллического поля предполагается, что между лигандами и комплексообразователям происходит сложное электростатическое взаимодействия. С одной стороны, имеются силы притяжения между положительно заряженными катионами и комплексообразователя и отрицательно заряженными лигандами или полярными молекулами лиганда. С другой стороны, отрицательно заряженные лиганды или дипольные молекулы лигандов отталкиваются друг от друга, а также от внешних электронов комплексообразователя. Лиганды располагаются вокруг комплексообразователя таким образом, чтобы силы притяжения были максимальны, а силы отталкивания – минимальны.
Таким образом, лиганды оказывают влияние на энергетическое состояние d-электронов комплексообразователя.
Изобразим энергию d-орбиталей в изолированном атоме и в полях лигандов.
В октаэдрическом поле лигандов энергия d-орбиталей, расположенных вдоль осей x, y, z, возрастает, а энергия d-орбиталей, направленных между осями x, y, z, уменьшается. Таким образом, происходит расщепление d-подуровня на величину Dокт.
В тетраэдрическом поле лигандов Dтетр меньше, чем Dокт и расположение d-орбиталей обратное октаэдрическому.
По влиянию на величину энергии ращепления D у 3d-элементов лиганды располагаются в ряд:
5.6. Диссоциация КС в растворе
Внутренняя и внешняя сферы комплекса различны по устойчивости. Ионы внешней сферы диссоциируют легко по типу солей. Эта диссоциация называется первичной. Лиганды внутренней сферы диссоциируют по стадиям и в очень малой степени. Эта диссоциация называется вторичной. Например,
Первичная диссоциация:
 == 3K+ + [Fe(CN)6]3− , диссоциация велика.
== 3K+ + [Fe(CN)6]3− , диссоциация велика.
Вторичная диссоциация:
[Fe(CN)6] 3− == Fe3+ + 6CN− , диссоциация крайне мала.
Прочность КС определяется величиной константы нестойкости (КН), чем она больше, тем менее прочен комплекс.
Запишем диссоциацию КС в общем виде:
[KLn] == K + nL,
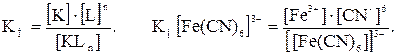
Д.з. Г., с. 154-156, 582-586, 594-604;
К., с. 65-81.
Строение вещества в конденсированном состоянии
Молекулярно-кинематическая теория жидкого состояния. Твердые вещества. Фазовые переходы. Металлические кристаллы. Металлическая связь.
Вещества могут находиться в трех физических состояниях: газообразном, жидком и твердом. При очень высоких температурах возникает особая разновидность газового состояния – плазма. Твердое и жидкое состояние объединяют общим названием – «конденсированное состояние».
Агрегатное состояние вещества в общем случае определяется температурой и давлением. Обычно при характеристике агрегатного состояния вещества имеются в виду: температура 25°С, давление 760 мм. рт. ст.
Твердое вещество может находиться в кристаллическом и аморфном состоянии (например, стекло). Кристаллическое состояние наиболее устойчивое, чем аморфное.
В газообразном состоянии молекулы находится друг от друга на значительных расстояниях (10–7 м) и занимают очень малую долю объема. Структура вещества в газообразном состоянии не упорядочена. Их состояние определяется законами идеальных газов. Например, закон Менделеева-Клапейрона: р·V = n·R·T, где р – давление, V – объем, n – число молей газа, R – газовая постоянная, 8,3 Дж/моль·К, T – абсолютная температура.
В 1811 г. итальянский ученый А. Авогадро высказал гипотезу, получившую позднее название закона Авогадро:
«В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул».
В одном моль содержится 6,02·1023 молекул. При стандартных (нормальных) условиях моль газа занимает объем 22,4 л. Молярную массу газа можно определить, используя состояние идеального газа:
 где m – масса газа.
где m – масса газа.
В жидком состоянии расстояния между частицами значительно меньше, чем в газообразном. Частицы занимают основную часть объема, постоянно соприкасаются друг с другом и притягиваются друг к другу.
Наблюдается некоторая упорядоченность частиц (это называется ближним порядком).
В твердом состоянии частицы сближены друг с другом, что между ними возникают прочные связи.
Практически отсутствует движение частиц относительно друг друга и существует высокая упорядоченность структуры.
6.1. Молекулярно-кинетическая теория жидкого состояния
В жидком состоянии между частицами возникают силы Ван дер Ваальса (диполь-дипольное, индукционное, дисперсионное). Эти взаимодействия удерживают молекулы около друг друга и приводят к некоторому их упорядочиванию или объединению частиц. Эти объединения получили названия кластеров. В случае одинаковых частиц кластеры в жидкости называются ассоциатами.
Водородные связи и силы Ван дер Ваальса непрочны, поэтому молекулы в жидкости находятся в непрерывном движении (оно получило название броуновского). Отдельные молекулы обладающие относительно высокой энергией, могут вырываться из жидкости и переходить в газообразное состояние. Этот процесс называется испарением. Склонность жидкости к испарению называют летучестью. Чем меньше силы межмолекулярного взаимодействия, тем выше летучесть жидкости.
Для жидкого агрегатного состояния характерны:
1) изотропия – одинаковость физических свойств по всем направлениям;
2) текучесть – способность легко изменять внешнюю форму под воздействием малых нагрузок. В жидкостях существует ближний порядок в расположении и молекул, который проявляется в том, что число соседних молекул для каждой молекулы одинаково;
3) самодиффузия, т.е непрерывные переходы молекул с места на место.
6.2. Твердые тела
Твердое состояние вещества определяются тем, что энергия взаимодействия его частиц выше кинетической энергии их движения:
Евзаим. > Екин.
Твердые вещества могут находиться в амфорном или кристаллическом состояниях.
Вещества в амфорном состоянии не имеют упорядоченный структуры. Подобно жидкости у них наблюдается только ближний порядок. некоторые из них очень медленно текут. Например, при длительном сроке службы оконные стекла внизу толще, чем в верхней части. В амфорном состоянии также могут находиться многие полимеры, смолы, простые вещества (Sе Si, Ag и др.), оксиды (SiO2, B2O3 и др.), сульфаты, карбонаты и др.
Аморфные вещества – изотропны, т.е. имеют одинаковые свойства во всех направлениях.
Подавляющие большинство твердых тел находятся в кристаллическом состоянии. Кристаллическое состояние характеризуется дальним порядком, т.е. трехмерной периодичностью структуры по всему объему твердого тела. Регулярное расположение частиц в твердом теле изображается в виде решетки, в узлах которой находятся те или иные частицы:
Кристаллические вещества плавятся при определенной температуре, называемой температурой плавления.
Кристаллы характеризуются энергией и постоянной кристаллической решетки.
В зависимости от природы частиц, образующих кристалл, и характера связи между ними различают четыре основные типа кристаллических веществ, или кристаллических решеток: атомную, ионную, металлическую и молекулярную.

Рис. Основные типы структур кристаллических решеток: а – атомная; б – ионная,
в – металлическая; г – молекулярная
В узлах атомной кристаллической решетки находятся атомы одинаковых или различных элементов. Примеры: алмаз, кварц, кремний и др.
Ионные кристаллические решетки построены из положительно и отрицательно заряженных ионов, между которыми действуют электростатические (кулоновские) силы притяжения. Например, NaCl, (NH4)2SO4.
Металлическая кристаллическая решетка состоит катионов металла, между которыми относительно свободно перемещаются валентные электроны. Пример: все металлы.
В узлах молекулярной кристаллической решетки расположены молекулы, связанные между собой слабыми межмолекулярными связями. Например, I2, лед и др.
Важнейшей характеристикой любой кристаллической решетки является ее энергия. Энергия кристаллической решетки – это энергия, необходимая для разрушения одного моля кристалла и удаления частиц за пределы их взаимодействия. Наибольшая энергия кристаллической решетки характерная для ионных и атомных кристаллов, меньшая – для металлических и еще меньшая – для молекулярных кристаллов.
Наименьшей структурой единицей кристалла, которая выражает все свойства его симметрии, является элементарная ячейка. Различают семь видов кристаллических систем: кубическая, тетрагональная, гексагональная, ромбическая, ромбоэдрическая, моноклинная, триклинная и 14 типов элементарных ячеек.
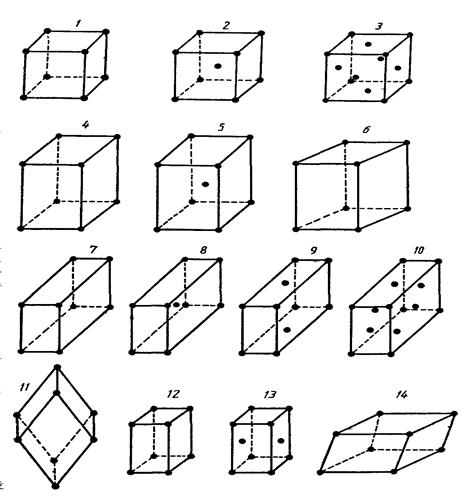
Рис. . Основные системы кристаллов:
1-3 – кубические; 4, 5 – тетрагональные; 6 – гексагональная; 7-10 – ромбические;
11 – ромбоэдрическая; 12, 13 – моноклинные; 14 – триклинная
6.3. Фазовые переходы
Фаза – однородная часть системы, отделенная от других частей поверхностью раздела и имеющая одинаковые свойства во всех своих точках. Например, раствор с осадком имеет две фазы: твердая – осадок и жидкая – раствор. Понятие фазы не следует смешивать с понятием о веществе. Раствор может содержать много растворенных веществ, но это одна фаза.
Фазовыми переходами называют превращения одной фазы в другую. К фазовым переходам относятся такие процессы, как плавление, испарение, возгонка, и обратные процессы – затвердевание, конденсация, сублимация.
Вещество может совершать шесть фазовых переходов:

 газ
газ
 |  |

 жидкость твердое тело.
жидкость твердое тело.
6.4. Металлические кристаллы. Металлическая связь
Большинство элементов периодической системы относятся к металлам (примерно 90). Металлы характеризуются рядом особых свойств: высокой электро- и теплопроводностью, ковкостью, пластичностью, металлическом блеском и высокой отражательной способностью по отношению к свету. Эти специфические свойства металлов можно объяснить особым типом химической связи – металлической.
У большинства металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали бы всему атому. Согласно теории металлической связи в узлах кристаллической решетки металлов находятся положительно заряженные ионы, которые погужены в электронный «газ», распределенный по всему металлу. Таким образом, валентные электроны у металлов не локализированы. Между положительно заряженными ионами металлов и нелокализированными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с металлической связью (s- и р-металлы) характеризуются относительно невысокими температурами плавления и твердостью. Наличие электронов, которые могут свободно перемещаться по всему объему кристалла, обеспечивают высокие электро- и теплопроводимость, а также ковкость и пластичность. Металлический блеск обусловлен отражением, световых лучей от электронного «газа», который выходит за границу положительно заряженных ионов металла.
| <== предыдущая лекция | | | следующая лекция ==> |
| | | ОЧИСТКА И СОРТИРОВАНИЕ ЦЕЛЛЮЛОЗЫ |
Дата добавления: 2016-12-16; просмотров: 2516;











