КОАГУЛЯЦИЯ КОЛЛОИДОВ
КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные частицы имеют весьма малые размеры (см. табл. 11.1) и поэтому участвуют в броуновском движении, в то же время они обладают заметной скоростью диффузии (10-1 ¸ 10-3 см2/с), что способствует выравниванию концентрации частиц по объему. Кроме того, если раздробить 1 см3 вещества до размера коллоидной частицы, то суммарная площадь всех граней дисперсной фазы составит от 60 до 600 м2. В этом случае частицы приобретают избыточную энергию, вследствие чего увеличивается адсорбция. Коллоидные растворы – принципиально неустойчивые системы. Они стремятся к самопроизвольному уменьшению межфазной поверхности, то есть к снижению дисперсности.
Свойство коллоидных систем увеличивать размер частиц путем их агрегации называется агрегативной неустойчивостью. Агрегативная неустойчивость преодолевается путем адсорбции ионов или молекул на частицах дисперсной фазы, за счет чего на границе раздела фаз формируется скачок потенциала. Благодаря этому коллоидные системы обладают весьма высокой агрегативной устойчивостью, что при малых размерах частиц способствует седиментационной[*] устойчивости, так как гравитационная сила, вызывающая седиментацию, нивелируется силами диффузии.
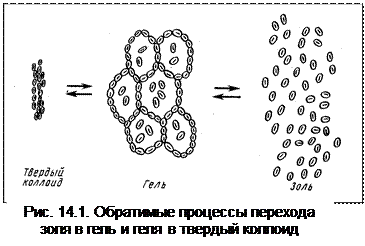 По характеру взаимодействия дисперсной фазы и дисперсионной среды коллоидные растворы можно подразделить на лиофобные (частицы дисперсной фазы практически не взаимодействуют с дисперсионной средой) и лиофильные коллоиды (растворы высокомолекулярных соединений), которые могут образовываться самопроизвольно, благодаря сильному взаимодействию дисперсной фазы и дисперсионной среды. Они способны сохранять агрегативную устойчивость без стабилизатора в двухкомпонентном растворе. Лиофильные системы термодинамически устойчивы (ΔG≤0) и характеризуются самопроизвольным диспергированием. Так, мыла и многие глины (например, бентонитовая) самопроизвольно «распускаются» в воде, а ВМС растворяются в «хорошем» растворителе до отдельных макромолекул и представляют собой истинные растворы. При длительном хранении гидрофильные золи переходят в гели. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняются молекулы воды. Гель можно высушить, превратив его в твердый коллоид (рис. 14.1).
По характеру взаимодействия дисперсной фазы и дисперсионной среды коллоидные растворы можно подразделить на лиофобные (частицы дисперсной фазы практически не взаимодействуют с дисперсионной средой) и лиофильные коллоиды (растворы высокомолекулярных соединений), которые могут образовываться самопроизвольно, благодаря сильному взаимодействию дисперсной фазы и дисперсионной среды. Они способны сохранять агрегативную устойчивость без стабилизатора в двухкомпонентном растворе. Лиофильные системы термодинамически устойчивы (ΔG≤0) и характеризуются самопроизвольным диспергированием. Так, мыла и многие глины (например, бентонитовая) самопроизвольно «распускаются» в воде, а ВМС растворяются в «хорошем» растворителе до отдельных макромолекул и представляют собой истинные растворы. При длительном хранении гидрофильные золи переходят в гели. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняются молекулы воды. Гель можно высушить, превратив его в твердый коллоид (рис. 14.1).
Все процессы обратимы:
золь « гель « твердый коллоид.
СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ
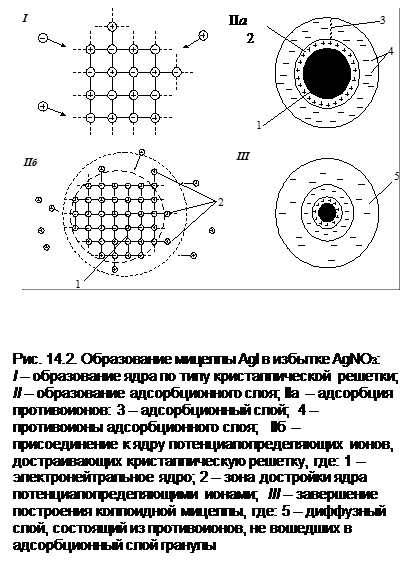
В основу современных представлений о строении коллоидных частиц легли работы российских ученых А.В. Думанского, Н.П. Пескова, С.М.Липатова, А.Н. Фрумкина, а также зарубежных исследователей Паули, Фаянса, Кройта и других. Строение коллоидных частиц удобнее рассматривать, если проследить процессы образования частиц на примере образования коллоидной частицы AgI:
AgNO3 + KI↔ AgI¯ + KNO3.
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag+ и I- образуют кристаллическую решетку. Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. При избытке AgNO3 в растворе будут находиться ионы Ag+ и NO3–. Построение кристаллической решетки AgI, согласно правилу Панета-Фаянса, может идти только за счет ионов, входящих в ее состав, в данном случае – за счет ионов Ag+. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, входя в его структуру и сообщая ему электрический заряд (рис. 14.2-1), определяющий так называемый электротермодинамический потенциал. В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами (рис. 14.2-IIб). Величина электротермодинамического потенциала (φ или E-потенциала) у многих коллоидных частиц достигает 1 В. Частицы с таким высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3- (противоионы) (рис. 14.2-IIa).
В процесс адсорбции противоионов устанавливается динамическое равновесие между адсорбированными и свободными ионами. Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой или плотную часть двойного электрического слоя. Ядро и адсорбционный слой вместе составляют гранулу. Гранула вместе с диффузным слоем образует мицеллу (рис. 14.2-III).
 Строение электрического двойного слоя можно представить в виде следующей схемы (рис. 14.3). На поверхности твердой фазы находятся потенциалопределяющие ионы 1. Противоионы распределяются между двумя слоями: часть противоионов входит в адсорбционный слой 2, толщина его очень невелика и противоионы распределяются в нем в плоскости параллельной поверхности твердой фазы, другая часть противоионов образует диффузный слой 3 с закономерно убывающей концентрацией ионов.
Строение электрического двойного слоя можно представить в виде следующей схемы (рис. 14.3). На поверхности твердой фазы находятся потенциалопределяющие ионы 1. Противоионы распределяются между двумя слоями: часть противоионов входит в адсорбционный слой 2, толщина его очень невелика и противоионы распределяются в нем в плоскости параллельной поверхности твердой фазы, другая часть противоионов образует диффузный слой 3 с закономерно убывающей концентрацией ионов.
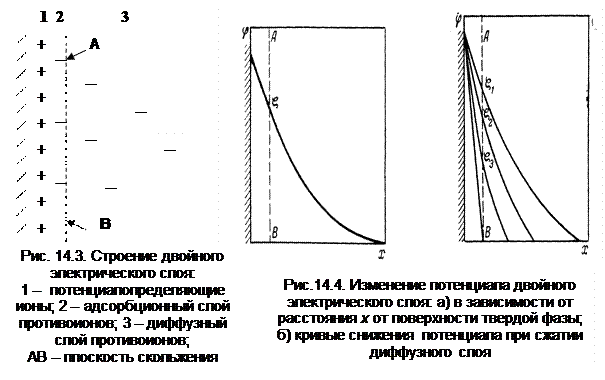
Потенциалопределяющие ионы создают поверхностный заряд; противоположный по знаку заряд сосредоточен в жидкой фазе. Разность потенциалов между твердой фазой и раствором – термодинамический потенциал – имеет какое-то определенное значение Е (j). По мере удаления от поверхности твердой фазы термодинамический потенциал уменьшается. В адсорбционном слое он уменьшается по прямой, как в плоском конденсаторе. В диффузном же слое снижение потенциала происходит по кривой, так как противоионы распределены в нем неравномерно (Рис. 14.4).
Наибольший интерес представляет потенциал на границе скольжения АВ. При движении дисперсной фазы в электрическом поле (электрофорезе) часть жидкости вместе с адсорбционным слоем противоионов перемещается вместе с ней. Потенциал на границе скольжения определяет скорость перемещения фаз при наложении электрического поля, т.е. является причиной всех электрокинетических явлений. Этот потенциал получил название электрокинетического или ζ – потенциала.
КОАГУЛЯЦИЯ КОЛЛОИДОВ
Процесс слипания коллоидных частиц называется коагуляцией. Её можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, центрифугированием, добавлением различных электролитов. Прибавление электролита к коллоидному раствору приводит к снижению электрокинетического потенциала и, следовательно, к уменьшению сил отталкивания. Вещество, коагулирующее дисперсную фазу коллоидной системы, называется коагулянтом, а ион, вызывающий этот процесс – коагулятором.
Закономерности коагуляции можно объединить в общие правила.
1. Все электролиты вызывают коагуляцию коллоидных растворов при увеличении концентрации до некоторого значения. Минимальная концентрация, вызывающая коагуляцию, называется порогом коагуляции.
2. Коагулирующим действием обладает ион, который имеет заряд, одноименный с зарядом противоионов мицеллы.
3. Ионы высшей валентности вызывают коагуляцию при гораздо меньших концентрациях, чем ионы низшей валентности. По сравнению с одновалентным ионом коагулирующая способность двухвалентного будет больше в несколько десятков раз, а трехвалентного – в несколько сот раз.
4. Коагулирующая способность ионов одинаковой валентности возрастает с увеличением радиуса иона. Ионы органических соединений всегда обладают более высокой коагулирующей способностью.
5. При увеличении концентрации электролита в растворе уменьшается электрокинетический потенциал, и коагуляция наступает при его определенном значении – критическом потенциале. В большинстве случаев критический потенциал равен 0,03 В.
Различают два вида коагуляции коллоидных растворов электролитами: концентрационную и нейтрализационную. Первая наблюдается при увеличении концентрации индифферентного электролита, не вступающего в химическое взаимодействие с компонентами коллоидного раствора. Такие электролиты не должны иметь ионов, способных достраивать кристаллическую решетку агрегата коллоидной мицеллы и вступать в реакцию с потенциалопределяющими ионами. При увеличении концентрации индифферентного электролита диффузный слой противоионов мицеллы сжимается, в результате чего электрокинетический потенциал уменьшается вплоть до нуля. Такое состояние коллоидной системы называется изоэлектрическим.
При нейтрализационной коагуляции ионы прибавляемого электролита нейтрализуют потенциалопределяющие ионы, уменьшается термодинамический потенциал и, соответственно, уменьшается и ζ-потенциал.
Основная причина коагуляции частиц заключается не столько в достижении некоторого (для всех случаев постоянного) критического ζ-потенциала, сколько в понижении расклинивающего давления, которое перестает препятствовать объединению частиц. Необходимое понижение этого давления достигается уменьшением диффузного слоя, что в свою очередь ведет к соответствующему понижению величины ζ-потенциала.
Коагуляцию можно ускорить, повышая скорость движения частиц, что помогает им преодолевать расклинивающее давление. Ускорения движения частиц можно добиться, например, повышением температуры раствора. Повышением концентрации золя также можно ускорить его коагуляцию, поскольку с увеличением концентрации растет число эффективных столкновений между мицеллами.
Коагулирующее действие электролитов зависит от величины заряда иона, который противоположен заряду коллоидной частицы. При достаточной концентрации электролита практически все противоионы окажутся в адсорбционном слое, заряд частицы снизится до нуля; отсутствие диффузного слоя обусловит значительное понижение давления расклинивания, и коагуляция пойдет с максимальной скоростью.
Коагулирующее действие иона коагулятора тем больше, чем больше его заряд (правило Шульце-Гарди). Значения порогов коагуляции для одно-, двух- и трехвалентных ионов относятся как 1: (1/2)6:(1/3)6 или 1:0,016:0,0013.
МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ КОЛЛОИДОВ
Коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо раздроблением частиц грубодисперсных систем. В отдельную группу может быть выделен метод получения с помощью пептизации.
Методы конденсации
Метод физической конденсации
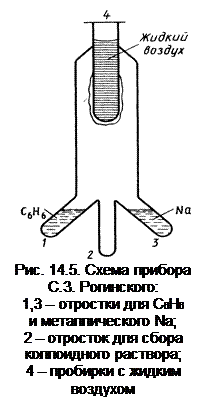
Этот метод основан на конденсации паров в вакууме на поверхности сосуда, охлажденного жидким воздухом (рис. 14.5). Для этого в отростках 1 и 3 прибора подвергаются испарению одновременно диспергируемое вещество (например, натрий) и дисперсионная среда (например, бензол) при температуре 673 К. Пары этих веществ конденсируются на поверхности сосуда 4, охлаждаемого жидким воздухом до 197 К, при этом охлажденный твердый бензол, намерзающий на стенках, содержит затвердевший натрий. После удаления из сосуда 4 жидкого воздуха температура постепенно повышается, оттаявшая смесь бензола с натрием попадает в отросток 2, образуя коллоидный раствор натрия в бензоле.
 Перевести растворенное вещество, находящееся в молекулярно-дисперсном раздроблении в коллоидное раздробление можно заменой одного растворителя другим. Для этого необходимо иметь два смешивающихся между собой растворителя, один из которых хорошо растворяет вещество, а другой – не растворяет. Так, мастика хорошо растворима в спирте и почти не растворима в воде. При добавлении к спиртовому раствору мастики воды происходит резкое понижение растворимости мастики, в результате чего молекулы соединяются в коллоидные частицы. Так же получают коллоидные растворы серы или канифоли.
Перевести растворенное вещество, находящееся в молекулярно-дисперсном раздроблении в коллоидное раздробление можно заменой одного растворителя другим. Для этого необходимо иметь два смешивающихся между собой растворителя, один из которых хорошо растворяет вещество, а другой – не растворяет. Так, мастика хорошо растворима в спирте и почти не растворима в воде. При добавлении к спиртовому раствору мастики воды происходит резкое понижение растворимости мастики, в результате чего молекулы соединяются в коллоидные частицы. Так же получают коллоидные растворы серы или канифоли.
Методы химической конденсации
К этой группе относятся методы, основанные на проведении в растворе химических реакций, сопровождающихся образованием нерастворимых или труднорастворимых веществ. Так, красный золь золота получают восстановлением соли золота формальдегидом до металлического золота с образованием золя золота по схеме:
2NaAuO2+3HCOH+Na2CO3 = 2Au+3HCOONa+NaHCO3+H2
На образующихся частичках (кристалликах золота) адсорбируются ионы AuO2–. Аналогичным образом получают желто-коричневый золь серебра.
При действии на каменную соль NaCl радиоактивного излучения выделяется металлический натрий, который, распределяясь в кристаллической среде, обусловливает голубое окрашивание кристаллов.
Золи образуются также в результате химической реакции двойного обмена, в результате которых образуется нерастворимое вещество, которое при соответствующих условиях превращается в коллоидный раствор.
Процесс гидролиза различных растворимых соединений (например, FeCl3) часто сопровождается образованием нерастворимых веществ, которые превращаются в коллоидные растворы.
Дисперсионные методы
Метод механического раздробления
В основе этих методов лежит раздробление твердых тел до частиц коллоидного размера. Процесс раздробления осуществляется: механическим или электрическим раздроблением, действием ультразвука. Механическое раздробление проводят в коллоидных мельницах (см. рис. 14.6). Частички вещества в предварительно измельченном виде смешиваются с соответствующей жидкостью, содержащей стабилизатор, и в виде взвеси подаются через загрузочное отверстие. При помощи быстро вращающихся лопастей взвесь приводится в быстрое вращение, в результате чего частицы вещества приобретают скорость и, ударяясь о неподвижные выступы, разбиваются на мелкие частицы.
 Получение коллоидных частиц
Получение коллоидных частиц
методом электрического распыления
Этот метод состоит в том, что через какую-либо дисперсионную среду (воду, например) пропускают электрический ток между электродами, изготовленными из материала, коллоидный раствор которого хотят получить. Так, для получения золя платины используют платиновые электроды, пропуская между ними электрическую дугу. При этом один электрод распыляется.
Получение коллоидных растворов с помощью ультразвука
Колебания воздуха с большой частотой (105 ¸ 106 Гц) называются ультразвуковыми волнами, которые образуются благодаря применению так называемых пьезоэлектрических осцилляторов. При этом взвесь грубодисперсного вещества под действием ультразвуковых волн размельчается до коллоидного состояния. Этим методом можно получить коллоидные растворы смол, гипса, графита, металлов, красителей, крахмала и многих других веществ.
Метод пептизации
В отличие от других методов образования коллоидных растворов при пептизации не происходит изменения степени дисперсности частиц. Ионы пептизатора хорошо адсорбируются на поверхности коллоидных частиц осадка и обусловливают их переход в золь. Различают непосредственную (если на поверхности частиц адсорбируется непосредственно добавленный пептизатор) и посредственную пептизацию (на поверхности адсорбируется продукт взаимодействия пептизатора с веществом дисперсной фазы).
Пример непосредственной пептизации – диспергирование студенистого осадка Fe(OH)3 при действии на него FeCl3.
Примером посредственной пептизации может служить получение того же золя Fe(OH)3 при действии разбавленной соляной кислоты. При этом часть молекул Fe(OH)3, взаимодействуя с соляной кислотой, переходят в оксохлорид железа (FeOCl). Молекулы FeOCl, адсорбируясь на поверхности частиц осадка Fe(OH)3, переводят его в коллоидное состояние.
Дата добавления: 2016-12-16; просмотров: 4350;











